Szczepionka przeciw COVID-19
Podsumowanie – Szczepionka przeciw COVID-19
O chorobie
COVID-19 jest ostrą wirusową chorobą układu oddechowego. W związku z tym, że choroba pojawiła się w nieuodpornionej populacji nagle w drugiej połowie 2019 roku, zaczęła się szerzyć w sposób niekontrolowany i w błyskawicznym tempie dotknęła społeczeństwa wszystkich krajów na świecie, wywołując kryzys zdrowia publicznego w niespotykanej skali.
Objawy COVID-19 są zbliżone do innych infekcji układu oddechowego i postawienie diagnozy wymaga wykonania badań laboratoryjnych. Najczęściej u zakażonych pacjentów obserwuje się: gorączkę, suchy kaszel, ból gardła, uczucie zmęczenia lub osłabienia. Rzadziej występują: bóle mięśniowe, biegunka, zapalenie spojówek, ból głowy, utrata węchu lub smaku, wysypka lub odbarwienia na palcach rąk lub stóp. W ciężkim przebiegu COVID-19 mogą wystąpić: duszność, ból/uczucie nacisku w klatce piersiowej, zaburzenia mowy (afazja), zaburzenia ruchowe. Większość zakażonych przechodzi chorobę łagodnie, aczkolwiek są opisywane długoterminowe powikłania nawet wśród osób, które łagodnie przeszły infekcję. Osoby starsze oraz osoby z chorobami towarzyszącymi mają podwyższone ryzyko ciężkiego przebiegu oraz wystąpienia powikłań w przebiegu COVID-19.
Do listopada 2022 r. oficjalnie odnotowano na świecie niemal 7 mln zgonów z powodu COVID-19, a szacunki wskazują, że rzeczywista liczba ofiar śmiertelnych w skali globalnej przekracza 20 mln osób. W krajach UE COVID-19 spowodował śmierć ponad 1,1 mln osób – jednak prawdopodobnie rzeczywista liczba śmiertelnych ofiar pandemii w UE jest jeszcze większa. COVID-19 ma również wpływ na miliony osób żyjących z długoterminowymi skutkami choroby.
Rejestrowana śmiertelność z powodu COVID-19 waha się w poszczególnych krajach od 0,1 do ponad 10 %, w zależności od kryteriów testowania oraz dostępu do służby zdrowia. Wraz z coraz szerszym uodpornieniem społeczeństwa drogą naturalną (przechorowanie) lub sztuczną (zaszczepienie), COVID-19 staje się jedną z sezonowych chorób, z którą służby sanitarne walczą jak z dziesiątkami innych chorób zakaźnych ludzi.
O szczepionce
W krajach Unii Europejskiej do obrotu dopuszczone są szczepionki mRNA, szczepionki wektorowe oraz rekombinowane szczepionki białkowe wzmocnione adiuwantem. Szczepionki te chronią przed objawami COVID-19 wywołanymi przez wirusa SARS-CoV-2. Zalecane są szczepienia w schemacie podstawowym oraz kolejne dawki przypominajce. Od 2022 roku udostępniane są kolejne szczepionki zaktualizowane do najczęściej krążących wariantów SARS-CoV-2.
W dużych badaniach klinicznych oraz badaniach obserwacyjnych potwierdzono wysoką skuteczność kliniczną szczepionek oraz efektywność w ochronie przed wystąpieniem objawów COVID-19, w tym szczególnie obejmujących ciężki przebieg choroby z hospitalizacją. W badaniach tych brały udział również osoby z chorobami towarzyszącymi. Po podaniu szczepionki mogą wystąpić działania niepożądane, najczęściej pod postacią: bólu lub obrzęku w miejscu wstrzyknięcia, zmęczenia, bólu głowy, bólu mięśni i dreszczy, bólu stawów, gorączki.
Szczepionki przeciw COVID-19 pomogły uniknąć 20 mln zgonów na całym świecie i pół miliona zgonów w Europie w pierwszym roku wdrażania programów szczepień.
O chorobie
Co to jest COVID-19?
COVID-19 jest ostrą chorobą zakaźną wywoływaną przez wirus SARS-CoV-2. Do zakażenia dochodzi drogą kropelkową, a czasami także przez kontakt ze skażoną powierzchnią.
Wirus SARS-CoV-2 należy do grupy betakoronawirusów i jest spokrewniony z innymi koronawirusami występujących szeroko w świecie zwierzęcym. Od początku XXI wieku, znane są dwa przypadki, w których koronawirusy przeszły ze świata zwierzęcego na ludzi, wywołując zagrożenie zdrowia publicznego. W 2002 roku wybuchła epidemia zespołu ostrej niewydolności oddechowej SARS w południowo-wschodniej Azji, która szybko rozprzestrzeniała się na inne kontynenty i wygasła w 2004 roku z nieznanych powodów. W 2012 roku w Arabii Saudyjskiej wykryto nowy typ koronawirusa powodującego bliskowschodni zespół niewydolności oddechowej MERS, występujący głównie w krajach Bliskiego Wschodu wśród osób mających kontakt z wielbłądami. Obydwa ww koronawirusy wywoływały ciężkie objawy, często kończące się śmiercią zakażonych. Wirus SARS-CoV-2 pojawił się w pod koniec 2019 roku w populacji ludzkiej całkowicie podatnej na zakażenie i idealnie dostosował się do organizmu ludzkiego, wywołując błyskawicznie szerzącą się pandemię.
Po przedostaniu się do organizmu człowieka, wirus SARS-CoV-2 zakaża komórki posiadające receptory białka ACE2, czyli enzymu konwertującego angiotensynę typu II. Receptory te są „przepustką” wirusa do komórek ludzkich, dzięki którym może on wniknąć do komórek i zmuszać je do produkcji milionów swoich kopii i lawinowego zakażenia kolejnych komórek. Receptory ACE2 występują w nabłonku dróg oddechowych, w płucach, sercu, naczyniach krwionośnych, nerkach, wątrobie oraz w nabłonku przewodu pokarmowego.
Jak bardzo zakaźny jest wirus SARS-CoV-2?
COVID-19 jest mniej zaraźliwy niż grypa, jednak głównym problemem jest długi okres zakaźności. Okres wylęgania wynosi 2-14 dni (średnio 5-6 dni).
Wirus SARS-CoV-2 przenosi się:
- drogą kropelkową razem z wydzieliną z dróg oddechowych: podczas kaszlania, wydmuchiwania nosa, mówienia,
- drogą powietrzną wraz z aerozolem wydychanym przez chorego lub podczas procedur medycznych, np. intubacji,
- przez kontakt bezpośredni, podanie dłoni, uścisk, itp.,
- pośrednio, przez kontakt z powierzchnią skażoną wydzieliną chorego,
Osoba zakażona może zarażać innych zanim jeszcze pojawią się objawy choroby, tj.:
- dorosły chory może być źródłem zakażenia dla innych 1-3 dni przed wystąpieniem objawów choroby,
- chory z łagodnymi objawami może zakażać innych do 3 tygodni od wystąpienia objawów,
- chory z ciężkimi objawami może zakażać innych znacznie dłużej niż 3 tygodnie od wystąpienia objawów,
- zakażony bezobjawowy może zakażać przez okres 1-2 tygodni po zakażeniu.
Jeden chory zaraża średnio 2-3 osoby z bliskiego otoczenia.
Jakie są objawy COVID-19?
Objawy COVID-19 są zbliżone do innych infekcji układu oddechowego i postawienie diagnozy wymaga wykonania badań laboratoryjnych. Najczęściej u zakażonych pacjentów obserwuje się:
- gorączkę,
- suchy kaszel,
- ból gardła,
- uczucie zmęczenia lub osłabienia.
Rzadziej występują:
- bóle mięśniowe,
- biegunka,
- zapalenie spojówek,
- ból głowy,
- utrata węchu lub smaku,
- wysypka lub odbarwienia na palcach rąk lub stóp.
W ciężkim przebiegu COVID-19 mogą wystąpić:
- duszność,
- ból/uczucie nacisku w klatce piersiowej,
- zaburzenia mowy (afazja), zaburzenia ruchowe.
Co to jest PIMS?
Wieloukładowy zespół zapalny powiązany z COVID-19 (PIMS, pediatric inflammatory multisystem syndrome) lub MIS-C (multisystem inflammatory syndrom in children) oraz postać występująca u dorosłych (adults)- MIS-A jest późnym powikłaniem bezobjawowego lub objawowego zakażenia SARS-CoV-2, występującym po około 4 tygodniach od zakażenia. U podłoża PIMS leży dysregulacja immunologiczna prowadząca do nasilonego stanu zapalnego, obejmującego wiele narządów. Dzieci z PIMS wymagają leczenia szpitalnego, stosowania leków immunomodulujących, a niejednokrotnie intensywnej terapii. PIMS polega na uogólnionym stanie zapalnym, który uszkadza różne tkanki i narządy, czego skutkiem są typowe objawy: wysoka gorączka i uszkodzenia różnych narządów. PIMS może prowadzić do rozwoju powikłań sercowych ( w tym głównie ostrego zapalenia mięśnia sercowego) lub wstrząsu. Do najczęstszych trwałych powikłań choroby należą tętniaki tętnic wieńcowych , które mogą wystąpić niezależnie od ciężkości przebiegu choroby.
Częstość występowania przypadków PIMS szacowana jest na 1/3000 dzieci zakażonych SARS-Cov-2.
Śmiertelność PIMS w krajach Europy Zachodniej i Stanach Zjednoczonych wynosi 2%.
Pierwsze przypadki PIMS stwierdzono w Polsce w maju 2020 roku. Od października 2020 roku obserwowano znaczne zwiększenie liczby przypadków tej choroby, co odzwierciedlało zwiększona zapadalność na zakażenie SARS-CoV-2 w populacji dziecięcej.
Wykazano wysoką skuteczność szczepień przeciw COVID-19 w profilaktyce PIMS u nastolatków. Z badania Zambrano L.D. i wsp. (2022) wynika, że korzyści ze szczepienia przeciw COVID-19 u dzieci i młodzieży są większe niż wyjściowo oceniano. Szczepionka zapobiega powikłaniom po COVID-19 w postaci PIMS u dzieci w wieku 12-18 lat w 91 %. Wykazano, że 95% młodzieży hospitalizowanej z powodu PIMS i 100% pacjentów w stanie krytycznym wymagających podtrzymywania życia nie była zaszczepiona przeciw COVID-19. 39% niezaszczepionych pacjentów z PIMS wymagało podłączenia do aparatury podtrzymującej życie. Żadna osoba w wieku 12-18 lat zaszczepiona dwoma dawkami, u której wystąpił PIMS nie wymagała podłączenia do aparatury podtrzymującej życie.
Dysponujemy obecnie wystarczającymi danymi, aby stwierdzić, że dla populacji ogólnej dzieci w wieku 5-18 lat szczepienia przeciw COVID-19 należy uznać za skuteczną metodę profilaktyki PIMS, a nie czynnik ryzyka rozwoju tego powikłania.
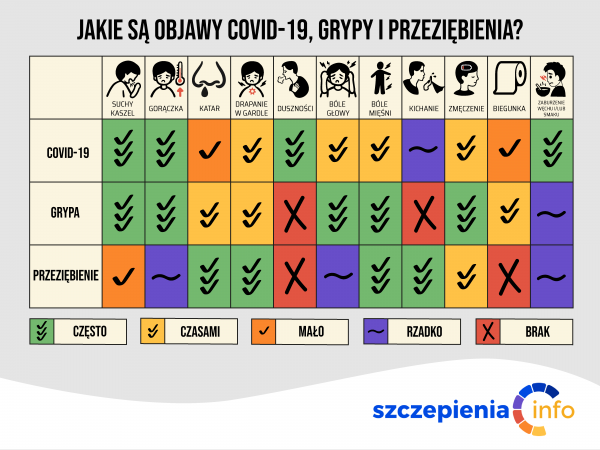
Jak odróżnić objawy COVID-19, grypy i przeziębienia?
• ból gardła
• katar
• kaszel
• kichanie
• bóle głowy, rzadko
• bóle mięśniowe
• gorączka rzadko, niewysoka
Objawy narastają stopniowo, w większości przypadków w ciągu 7-10 dni następuje powrót do zdrowia. Przeziębienie jest łagodną chorobą, z reguły nie występują powikłania (u osób z astmą oskrzelową lub innymi przewlekłymi chorobami układu oddechowego oraz niedoborem odporności może dojść do rozwoju zapalenia oskrzeli i/lub zapalenia płuc).
Objawy pojawiają się nagle:
• gorączka lub subiektywne poczucie gorączki, dreszcze
• kaszel, zwykle suchy
• ból gardła
• katar lub zatkany nos
• bóle mięśniowe i stawowe
• bóle głowy
• zmęczenie
• u niektórych pacjentów wymioty i biegunka (częściej u dzieci niż dorosłych)
Dominują objawy ogólne nad objawami ze strony dróg oddechowych. Gorączka i pozostałe objawy ogólne ustępują na ogół w ciągu tygodnia, kaszel utrzymuje się zwykle dłużej (2 tygodnie lub więcej). W większości przypadków grypa jest cięższą choroba niż przeziębienie, mogą wystąpić poważne powikłania, także u osób bez innych obciążeń zdrowotnych. Do grup ryzyka należą: kobiety ciężarne, dzieci do końca 5. roku życia, osoby w wieku ≥65 lat, pacjenci z chorobami przewlekłymi układu oddechowego, układu krążenia, układu nerwowego, nerek, z cukrzycą, chorobami nowotworowymi, niedoborem odporności.
Obraz kliniczny (mimo pewnych różnic) może być bardzo podobny zarówno do przeziębienia, jak i COVID-19, dla potwierdzenia rozpoznania konieczne jest wykonanie badań diagnostycznych (wymaz z nosogardła na badanie RT-PCR lub szybki test antygenowy).
Jak poważne mogą być objawy COVID-19?
COVID-19 jest nową chorobą i wiedza dotycząca szczególnie długoterminowych skutków zakażenia jest nadal niepełna. Większość zakażonych przechodzi chorobę łagodnie, aczkolwiek są opisywane długoterminowe powikłania nawet wśród osób, które łagodnie przeszły infekcję.
U ok. 5 % osób objawy (m.in. zmęczenie, bóle głowy, duszność lub zaburzenia węchu) mogą się utrzymywać ponad 8 tygodni po wystąpieniu objawów.
Osoby starsze oraz osoby z chorobami towarzyszącymi mają podwyższone ryzyko ciężkiego przebiegu oraz wystąpienia powikłań w przebiegu COVID-19. Wiele z tych powikłań może być związana ze zjawiskiem zwanym „burzą cytokinową”, kiedy to infekcja wirusowa stymuluje nasz własny układ odpornościowy do wywołania ogólnoustrojowego stanu zapalnego, niszczącego narządy wewnętrzne, często prowadząc do zgonu.
Dotąd opisano następujące powikłania COVID-19:
- zapalenie płuc często prowadzące do ostrej niewydolności oddechowej, kiedy to płuca są zalane płynem w wyniku procesu zapalnego i nie są w stanie dostarczać tlenu do organizmu i odprowadzać dwutlenku węgla (uszkodzenia mogą być trwałe),
- trwałe uszkodzenie mięśnia sercowego, które może zwiększać ryzyko wystąpienia niewydolności serca lub innych powikłań sercowych; m.in. zapalenie mięśnia sercowego,
- uszkodzenie nerek,
- wysypka, wypadanie włosów,
- powikłania neurologiczne – udar, drgawki, zespół Guillaina-Barrégo, zwiększone ryzyko rozwoju choroby Parkinsona i choroby Alzheimera; problemy ze snem, zaburzenia poznawcze (np. problemy z koncentracją, problemy z pamięcią),
- incydenty zakrzepowo-zatorowe, takie jak zator tętnicy płucnej, zawał serca, udar,
- problemy psychiczne – zespołu stresu pourazowego, depresja i zaburzenia lękowe.
Gdzie i jak często COVID-19 występuje na świecie?
Zakażenia wirusem SARS-CoV-2 zostały po raz pierwszy zidentyfikowane u ludzi w listopadzie 2019 roku. Kilka czynników spowodowało, że nowy wirus wywołał pandemię i sytuację kryzysową we wszystkich krajach świata. Po pierwsze, nowy wirus idealnie dostosował się do ludzkiego organizmu i z łatwością szerzy się drogą kropelkową, kontaktową i w mniejszym stopniu – powietrzną. Po drugie, stosunkowo łagodne, często bezobjawowe zakażenia wraz z bardzo długim okresem zakaźności, utrudniają wykrywanie ognisk zakażeń oraz śledzenie kontaktów. Po trzecie, bezprecedensowa globalizacja, natężenie ruchu lotniczego oraz zagęszczenia ludności w wielu regionach świata, stworzyły idealne warunki do błyskawicznego rozprzestrzeniania się zakażeń nowym koronawirusem na całym świecie.
Według stanu z 01.02.2022 roku, Światowa Organizacja Zdrowia zarejestrowała ponad 380 milionów potwierdzonych zachorowań oraz 5,7 milionów zgonów z powodu COVID-19. Ocenia się, że rejestrowanych jest mniej niż 1 na 10 zakażeń wirusem SARS-CoV-2 ze znacznymi różnicami pomiędzy krajami. Nie jest też rejestrowanych wiele zgonów które są bezpośrednio lub pośrednio związane z pandemią. Rejestrowana śmiertelność z powodu COVID-19 waha się w poszczególnych krajach od 0,1 do ponad 10 %, w zależności od kryteriów testowania oraz dostępu do służby zdrowia.
Z nielicznymi wyjątkami, tygodniowa liczba rejestrowanych zachorowań na poziomie globalnym, wzrasta nieustannie od początku pandemii. W początkowej fazie, liczba rejestrowanych zachorowań zwiększyła się od ok 20 tys. na początku marca do 500-700 tys. w kwietniu-maju 2020 roku. Następnie zanotowano wzrost do 1,5-2 milionów zachorowań tygodniowo w okresie od lipca do września 2020 r., po czym odnotowano 4-5 milionów zachorowań tygodniowo w listopadzie-grudniu 2020 roku. Na półkuli północnej, gdzie obserwuje się obecnie większość zachorowań, typowy sezon grypowy wykazuje największe nasilenie w styczniu i lutym. Wtedy warunki klimatyczne najbardziej sprzyjają szerzeniu się zakażeń drogą kropelkową. W związku z tym eksperci oczekują kolejnej fali wzrostów liczby zachorowań SARS-CoV-2 w najbliższych tygodniach.
Należy pamiętać, że nadal 80-90% społeczeństw nie zetknęła się z wirusem i jest podatnych na zakażenie. Pandemia będzie trwała dopóki ponad 85% społeczeństwa nie uodporni się drogą naturalną (przechorowanie) lub sztuczną (zaszczepienie). Po przekroczeniu tego progu odporności zbiorowiskowej, COVID-19 stanie się jedną z sezonowych chorób, z którą służby sanitarne będą walczyć jak z dziesiątkami innych chorób zakaźnych ludzi.
O szczepionce
Szczepienia przeciw COVID-19 zaktualizowaną szczepionką
Najnowsza białkowa szczepionka Novavax zaktualizowana do podwariantu XBB1.5 dostępna jest dla WSZYSTKICH OSÓB w wieku >12 lat.
Zgodnie z komunikatem Ministra Zdrowia od 6 grudnia będzie dostępna szczepionka przeciw COVID-19 zaktualizowana dla podwariantu XBB.1.5.
Szczepionka będzie dostępna dla wszystkich w wieku >12 lat.
Szczepionka jest zalecana szczególnie:
- osobom w wieku ≥60 lat,
- pacjentom z niedoborami odporności lub chorobami współistniejącymi zwiększającymi ryzyko ciężkiego przebiegu COVID-19 ((dotyczy osób w wieku ≥12 lat),
- pracownikom ochrony zdrowi, którzy mają bezpośredni kontakt z pacjentem lub materiałem zakaźnym.
Dostępna będzie szczepionka białkowa Nuvaxovid (Novavax) zaktualizowana do aktualnie dominującego podwariantu XBB.1.5.
Szczepionka Nuvaxovid będzie dostępna również dla osób, które wyrażają chęć zaszczepienia i spełniają warunek wieku (osoby, które ukończyły 12 r.ż.) i od ostatniego szczepienia upłynęło co najmniej 6 miesięcy.
W przypadku osób dotychczas nieszczepionych przeciw COVID-19 powyżej 12 roku życia należy podać 2 dawki w odstępie 3 tygodni.
Zalecany odstęp podania kolejnej dawki przypominającej od przyjęcia ostatniej dawki przypominającej w grupie wieku >12 lat wynosi co najmniej 6 miesięcy.
Zaktualizowane szczepionki aktualnie stosowane w realizacji szczepień przeciw COVID-19:
– Comirnaty (wariant Omicron): dwuwalentna szczepionka Comirnaty Original/Omicron BA.4-5. (BioNtech-Pfizer).
– Comirnaty w wersji dla dzieci Junior (0,6-4 lata) oraz (5-11 lat),
– Spikevax (wariant Omicron), dwuwalentna szczepionka Spikevax Bivalent Original/Omicron BA.4-5 (Moderna).
Dowiedz się, kiedy możesz otrzymać kolejną dawkę szczepionki przeciw COVID-19
Jakie szczepionki przeciw COVID-19 są dopuszczone do obrotu w Unii Europejskiej?
Źródło grafiki: https://www.facebook.com/komisjaeuropejska/

Obecnie w krajach Unii Europejskiej do obrotu dopuszczone są:
- Szczepionka mRNA o nazwie Comirnaty (BNT162b2) firm BioNTech i Pfizer. Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 21.12.2020). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku >6 miesięcy. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz ulotce dla pacjenta dołączonej do opakowania szczepionki.
- Zaktualizowane szczepionki dla wariantu Omikron do podawania jako dawki przypominające: szczepionka Comirnaty Original/Omicron BA.1. (BioNTech i Pfizer) i szczepionka Comirnaty Original/Omicron BA.4-5. (BioNtech i Pfizer).
- Zaktualizowana szczepionka dla podwariantu XBB1.5 do podawania jako dawka przypominająca: szczepionka Comirnaty Original/Omicron XBB1.5 (BioNTech i Pfizer).
- Szczepionka mRNA o nazwie Spikevax (mRNA 1273) firmy Moderna. Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 06.01.2021). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥6 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta.
- Zaktualizowana szczepionka dla wariantu Omikron do podawania jako dawki przypominające: szczepionka Spikevax Bivalent Original/Omicron BA.1. (Moderna) i BA.4-5 (Moderna).
- Zaktualizowana szczepionka dla podwariantu XBB1.5 do podawania jako dawka przypominająca: szczepionka Spikevax XBB1.5 (Moderna).
- Szczepionka wektorowa Vaxzevria (ChAdOx1 nCoV-19) (AstraZeneca). Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 29.01.2021). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat, w postaci dwóch dawek. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta (szczepionka obecnie w Polsce niedostępna).
- Szczepionka wektorowa Jcovden (COVID-19 Vaccine Janssen) (Janssen) (Ad26.COV.2-S). Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 11.03.2021). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta.
- Szczepionka rekombinowana białkowa Nuvaxovid (NVX-CoV2373) (Novavax). Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja wykonawcza Komisji Europejskiej z 20.12.2021 udzielająca na mocy rozporządzenia (WE) nr 726/2004 Parlamentu Europejskiego i Rady pozwolenia na dopuszczenie do obrotu produktu leczniczego stosowanego u ludzi „Nuvaxovid – Szczepionka przeciw COVID-19 (rekombinowana, z adiuwantem). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta.
- Szczepionka rekombinowana białkowa Nuvaxovid zaktualizowana do podwariantu XBB1.5 (Novavax).
- Szczepionka rekombinowana białkowa VidPrevtyn Beta (Sanofi Pasteur). Szczepionka przeciw COVID-19 (z adiuwantem). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta (szczepionka w Polsce niedostępna).
Europejska Agencja Leków
- prowadzi procedurę dopuszczenia do obrotu szczepionki przeciw COVID-19:
– szczepionki Skycovion (SK Chemicals GmbH).
- prowadzi procedurę wstępnej etapowej oceny (rolling review) 3 szczepionek przeciw COVID-19:
– szczepionki wektorowej Sputnik V (Gam-COVID-Vac) (Gamaleya Institute),
– szczepionki inaktywowanej (Vero Cell) z adiuwantem Sinovac,
– szczepionki inaktywowanej COVID-19 Vaccine HIPRA (PHH-1V) (HIPRA Human Health S.L.U.).
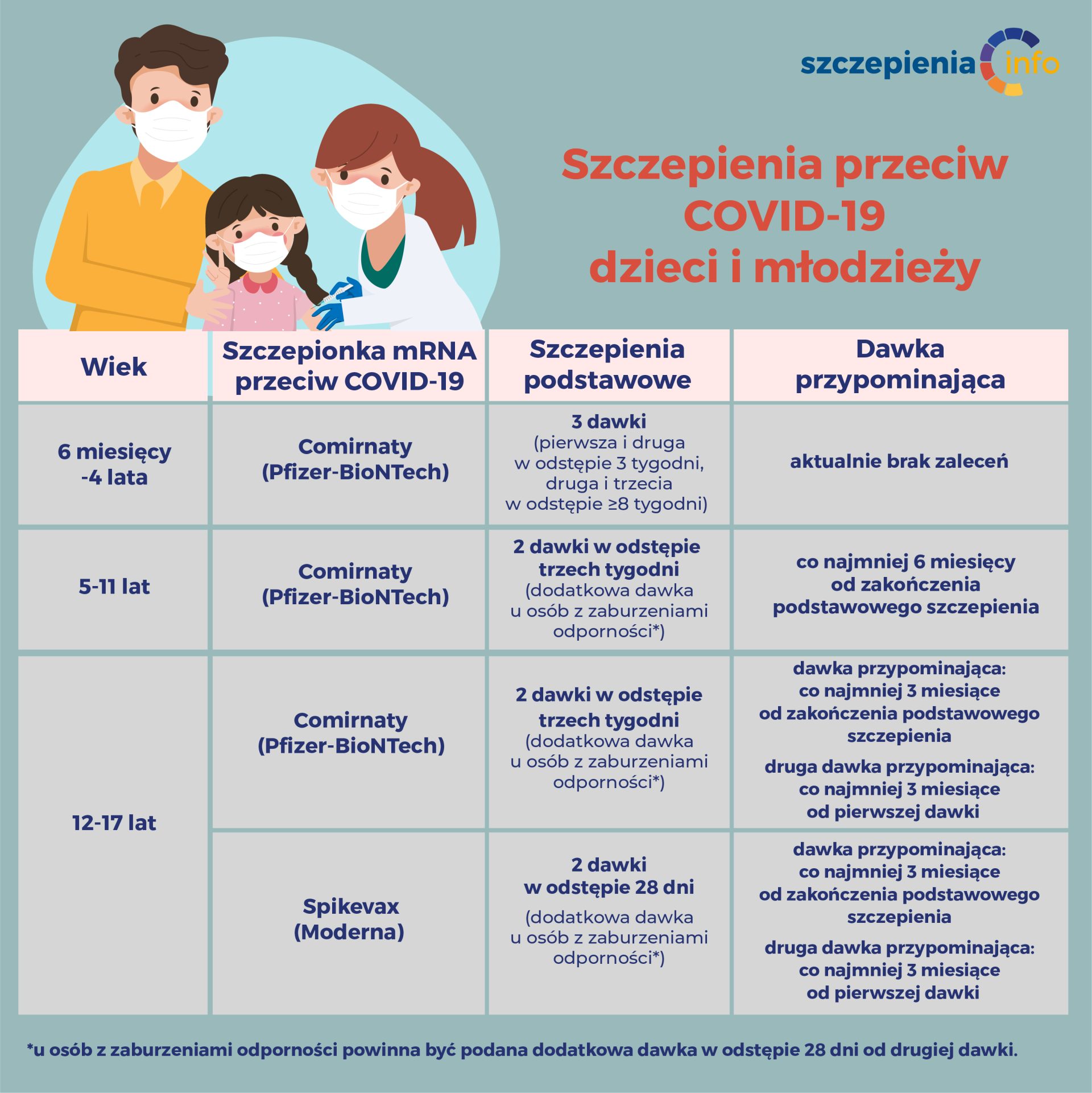
Jaką szczepionkę przeciw COVID-19 podajemy dla dzieci i młodzieży?
FAQ o szczepieniach przeciw COVID-19 dzieci w wieku 5-11 lat
Którą szczepionkę można podać dziecku w wieku 5-11 lat?
Szczepionkę mRNA o nazwie Comirnaty (Pfizer-BioNTech) w dawce pediatrycznej 10 mikrogramów (dzieciom, które skończyły 5 lat) lub szczepionkę Spikevax (Moderna) w dawce 50 mikrogramów (dzieciom, które skończyły 6 lat). W punktach szczepień dostępna jest szczepionka Comirnaty (Pfizer-BioNTech).
Ile dawek należy podać i w jakim odstępie czasu?
Schemat podstawowy: 2 dawki szczepionki Comirnaty w odstępie 3 tygodni. Dawka przypominającą po co najmniej 6 miesiącach od zakończenia schematu podstawowego. U dzieci z ciężkimi zaburzeniami odporności: schemat podstawowy: 2 dawki szczepionki Comirnaty w odstępie 3 tygodni oraz dawka uzupełniająca w odstępie co najmniej 28 dni po drugiej dawce. Dawka przypominającą po co najmniej 6 miesiącach od podania dawki uzupełniającej.
O ile można przesunąć podanie drugiej dawki?
Ważne jest aby podać dwie dawki zgodnie z zaleceniami, bez nieuzasadnionego wydłużania odstępów pomiędzy dawkami.
W jakim czasie od podania innej szczepionki (np. przeciw błonicy, tężcowi, krztuścowi i poliomyelitis lub szczepionki MMR przeciw odrze, śwince i różyczce) można podać szczepionkę przeciw COVID-19?
W dowolnym czasie. Nie ma konieczności zachowania jakiegokolwiek odstępu.
W jakim czasie od szczepienia przeciw COVID-19 można podać inną szczepionkę (np. przeciw błonicy, tężcowi, krztuścowi i poliomyelitis lub szczepionkę MMR przeciw odrze, śwince i różyczce)?
W dowolnym czasie. Nie ma konieczności zachowania jakiegokolwiek odstępu.
Czy to prawda, że dziecko w wieku 5-11 lat może być kwalifikowane do szczepienia tylko przez lekarza?
Tak to prawda. O kwalifikacji do szczepienia dzieci 5-11 lat decyduje każdorazowo lekarz.
Jak wygląda kwalifikacja dziecka do szczepienia?
Kwalifikacja dziecka do szczepienia przeciw COVID-19 obejmuje dwa elementy: 1/celowany wywiad przesiewowy przeprowadzony według ujednoliconego kwestionariusza, 2/przesiewowe badanie przedmiotowe (fizykalne) (więcej).
Czy można do szczepienia przeciw COVID-19 zarejestrować dziecko, które w tym roku skończy 5 lat?
Na szczepienie przeciw COVID-19 można zarejestrować dziecko, które w dniu przeprowadzenia szczepienia ukończyło 5 lat (szczepionka Comirnaty) lub 6 lat (szczepionka Spikevax).
Jaką dawkę szczepionki podać dziecku, które pomiędzy podaniem pierwszej i drugiej dawki ukończy 12 lat?
Należy podać szczepionkę w dawce i składzie zgodnym z wiekiem dziecka. Dziecku w wieku do ukończenia 11 lat dawkę szczepionki pediatrycznej (10 mikrogramów (Comirnaty) lub 50 mikrogramów (Spikevax)), a w przypadku ukończenia 12 lat dawkę, szczepionki podawanej nastolatkom (30 mikrogramów (Comirnaty) lub 100 mikrogramów (Spikevax).
Kto wypełnia kwestionariusz przed szczepieniem dziecka w wieku 5-11 lat?
Kwestionariusz wypełnia rodzic/przedstawiciel ustawowy. Na końcu formularza podaje swoje dane i podpisem wyraża zgodę na szczepienie.
Czy potrzebna jest zgoda obojga rodziców na kwestionariuszu?
Wystarczy zgoda jednego rodzica na kwestionariuszu.
Dlaczego dzieciom podajemy inną dawkę szczepionki niż nastolatkom?
Dzieci powinny otrzymać preparat odpowiedni dla ich wieku, niezależnie od wzrostu i masy ciała.
Preparat Comirnaty: dzieciom w wieku 5-11 lat podajemy dawkę 10 mikrogramów (0,2 ml), a nastolatkom od 12 lat i starszym dawkę 30 mikrogramów/dawkę (0,3 ml).
Preparat Spikevax: dzieciom w wieku 6-11 lat podajemy dawkę 50 mikrogramów (0,25 ml), a nastolatkom od 12 lat i starszym dawkę 100 mikrogramów/dawkę (0,5 ml).
Jak ustalono dawkę szczepionki dla dzieci w wieku 5-11 lat?
Dawkę szczepionki wybrano w badaniach klinicznych szczepionki, po ocenie różnych schematów dawkowania w celu ustalenia, która dawka wywołuje odpowiednią odpowiedź immunologiczną, jest bezpieczna i skuteczna.
Czy taka sama dawka powinna być podana dziecku, które jest niższe/mniej waży od większości swoich rówieśników?
Dawkę szczepionki dobiera się do wieku, a nie do masy ciała lub wysokości. Masa ciała nie determinuje wielkości dawki.
Czy w składzie szczepionki mRNA znajdują się substancje, które mogą być dla dziecka niebezpieczne?
Nie ma takiej możliwości. Wszystkie składniki szczepionki zostały dokładnie sprawdzone. Występują w niewielkiej ilości, która nie stanowi zagrożenia dla organizmu.
Czy składniki szczepionek mRNA mogą powodować długoterminowe, nieznane jeszcze działania niepożądane?
Różne rodzaje szczepionek stosujemy od dziesiątków lat. Stąd też wiemy, że działania niepożądane występują w ciągu pierwszych 4-6 tyg. po szczepieniu. mRNA w szczepionce jest wyjątkowo niestabilne i ulega degradacji w krótkim czasie od wstrzyknięcia. Podobnie inne składniki są szybko usuwane, nie pozostają w organizmie.
Czy składniki szczepionki po jej wstrzyknięciu mogą być powodem zakażenia SARS-CoV-2 u zaszczepionego dziecka lub doprowadzić do zakażenia innej osoby?
Nie ma takiej możliwości. Szczepionka mRNA nie zawiera wirusa ani żadnych jego fragmentów. Zawiera tylko fragment informacji genetycznej o syntezie wybranego białka wirusa.
Czy skład szczepionki jest kontrolowany?
Szczepionki są kontrolowane jeszcze dokładniej niż leki. Pierwszą kontrolę przeprowadziła specjalna instytucja, która w czasie rejestracji szczepionki sprawdziła szczegółowo wszystkie jej składniki, ich rodzaje i zawartość. Teraz każdą serię szczepionki wprowadzaną na rynek kontroluje producent szczepionki i niezależne od niego laboratorium państwowe.
Jak długo prowadzono badania nad nową technologią szczepionki mRNA?
Prototyp szczepionki mRNA przeciw COVID-19, ten który potem sprawdzano w badaniach klinicznych na ludziach, faktycznie opracowano w ciągu kilku miesięcy. Było to możliwe, ponieważ wcześniej badacze od 20 lat pracowali nad tym, aby opracować stabilną postać mRNA, które nie ulegnie degradacji, a będzie bazą do syntezy białka (antygenu) w szczepionce.
Czy poza szczepionkami przeciw COVID-19 znamy inne szczepionki opracowane z wykorzystaniem metod biologii molekularnej?
Tak i to więcej niż byśmy podejrzewali. Rekombinowana szczepionka przeciw wirusowemu zapaleniu wątroby typu B (wzwB), która podawana jest każdemu noworodkowi już w pierwszych dniach życia. Szczepionka przeciw meningokokom grupy B chroniąca przed niebezpieczną sepsą. Szczepionka przeciw rotawirusom (zawiera reasortanty – zmienione genetycznie wirusy) podawana niemowlętom. I kilka innych.
Czy po szczepieniu przeciw COVID-19 u dziecka mogą wystąpić działania niepożądane?
Tak, po szczepieniu przeciw COVID-19 mogą wystąpić działania niepożądane. Tak jak po podaniu innej szczepionki, leku, a nawet suplementu diety.
Jakie działania niepożądane występują najczęściej?
Najczęstsze działania niepożądane były podobne do występujących w grupie nastolatków. Obejmowały ból w miejscu wstrzyknięcia, zmęczenie, ból głowy, zaczerwienienie, obrzęk w miejscu wstrzyknięciu, ból mięśni, dreszcze. Miały charakter łagodny lub umiarkowany i ustępowały w ciągu kilku dni po szczepieniu.
Po której dawce możemy się spodziewać więcej działań niepożądanych?
Więcej działań niepożądanych występuje po drugiej dawce szczepionki.
Czy po szczepionce mRNA mogą wystąpić ciężkie działania niepożądane?
Ciężkie działania niepożądane, które mogłyby spowodować długotrwałe problemy zdrowotne, występują bardzo rzadko i są mało prawdopodobne po jakimkolwiek szczepieniu, w tym po szczepieniu przeciwko COVID-19.
Jakie jest ryzyko ciężkiego zdarzenia niepożądanego pod postacią zapalenia mięśnia sercowego?
Ryzyko jest ekstremalnie małe. Zapalenie mięśnia sercowego po szczepionkach mRNA przeciw COVID-19 zgłaszano najczęściej u mężczyzn w wieku poniżej 30 lat i zazwyczaj po drugiej dawce szczepionki. Przechorowanie COVID-19 jest związane z istotnie większym ryzykiem zapalenia mięśnia sercowego i innych powikłań kardiologicznych w porównaniu ze szczepieniem.
Jak długo oceniano bezpieczeństwo szczepionek mRNA?
Dopuszczona do obrotu szczepionka mRNA przeciw COVID-19 była sprawdzana w badaniach klinicznych bezpieczeństwa przez kilka miesięcy. Bezpieczeństwo szczepionek podawanych w masowym programie szczepień (w tym występowanie niepożądanych odczynów poszczepiennych) monitorowane jest ponad 12 miesięcy.
Czy każdy niepokojący objaw po szczepieniu należy zgłosić lekarzowi?
Tak, wszystkie niepokojące objawy należy zgłosić swojemu pediatrze lub lekarzowi rodzinnemu. Lekarz po badaniu dziecka stwierdza czy jest to niepożądany odczyn poszczepienny czy zwykła reakcja organizmu na podanie szczepionki.
Czy szczepionki mRNA zaburzają cykl menstruacyjny?
Zmiany cyklu menstruacyjnego po szczepieniu przeciw COVID-19 stanowią naturalną reakcję organizmu, który rozwija odpowiedź odpornościową po szczepieniu. Mają charakter tymczasowy.
Jaka działa szczepionka przeciw COVID-19 u dzieci?
Na podstawie mRNA podawanego w szczepionce wytwarzane jest białko (antygen), które jest sygnałem dla układu odpornościowego do wytworzenia specjalnych przeciwciał i komórek odpornościowych. Dzięki nim organizm jest chroniony przed objawami COVID-19 wywołanymi przez wirusa SARSA-CoV-2.
W jakim czasie po szczepieniu rozwija się maksymalna możliwa odpowiedź poszczepienna?
Pełna odporność po szczepieniu rozwija się w ciągu 2 tygodni od podania drugiej dawki szczepionki.
Jak sprawdzono skuteczność kliniczną szczepionki u dzieci?
Skuteczność szczepionki sprawdzono w badaniu klinicznym, w grupie ponad 2 000 dzieci w wieku od 5 do 11 lat lub od 6 do 11 lat. Obserwację prowadzono w grupie badanej (dawka pediatryczna) oraz grupie kontrolnej (placebo).
Jaka jest skuteczność szczepionki u dzieci?
Badanie prowadzono w grupie badanej (1305 dzieci) i kontrolnej (663 dzieci). Objawy COVID-19 wystąpiły u 3 osób z grupy badanej i 16 osób z grupy kontrolnej, co pozwoliło wyznaczyć 90,7% skuteczności szczepionki w ochronie przed objawowym COVID-19.
Dlaczego w badaniach klinicznych dzieci uczestniczyło mniej osób niż w podobnych badaniach prowadzonych u dorosłych?
Wcześniej szczepionkę o takim samym składzie jakościowym, tylko w większej dawce sprawdzono w badaniach klinicznych prowadzonych na grupie kilkudziesięciu tysięcy osób, potem podano setki milionów dawek szczepionki dorosłym i nastolatkom. Więc przechodząc do niższych grup wiekowych badacze mieli już dużo większą wiedzę o tej szczepionce, niż zwykle w przypadku jakiejkolwiek innej szczepionki pediatrycznej.
Czy szczepionka chroni również przed zakażeniem wirusem SARS-CoV-2?
Z badań efektywności szczepionki mRNA prowadzonych wśród nastolatków i dorosłych wynika, że szczepionka chroni w ograniczony sposób chroni przed zakażeniem wirusem SARS-CoV-2. Zakres ochrony zależy od wielu czynników, cały czas prowadzone są badania. Główny cel szczepionki to ochrona przed ciężkim przebiegiem i śmiercią z powodu choroby COVID-19.
Czy przed szczepieniem albo po szczepieniu można sprawdzić poziom przeciwciał?
Nie ustalono przydatności testów serologicznych do oceny odpowiedzi immunologicznej na szczepienie. Nie zaleca się wykonywania badań serologicznych w celu oceny odpowiedzi na szczepienie przed podaniem szczepionki ani po jej podaniu.
Czy dzieciom również będzie potrzebna dawka przypominająca szczepionki?
Biorąc pod uwagę dotychczasową wiedzę na temat czasu utrzymywania się odpowiedzi poszczepiennej u dorosłych oraz pojawiania się nowych wariantów wirusa, należy brać to pod uwagę. Potrzebujemy jednak więcej badań. Obecnie dawka przypominająca jest zalecana nastolatkom w wieku 12-17 lat i dorosłym.
Czy szczepionka chroni przed COVID-19 wywołanego przez nowe warianty wirusa SARS-CoV-2?
Tak, badania wskazują, że szczepionka zachowuje swoją skuteczność wobec nowych wariantów wirusa, szczególnie w zakresie ochrony przed ciężkim przebiegiem choroby i zgonem.
FAQ o bezpieczeństwie szczepionek przeciw COVID-19 u nastolatków.
Jaki rodzaj szczepionek przeciw COVID-19 można podawać nastolatkom?
Młodzieży w wieku 12-17 lat można podawać szczepionki mRNA przeciw COVID-19: Comirnaty (Pfizer-BioNTech) lub Spikevax (Moderna).
Ile dawek szczepionki należy podać?
2 dawki podstawowe oraz dawkę przypominającą.
Jaki odstęp należy zachować między dawkami szczepionki?
21 dni dla szczepionki Comirnaty (Pfizer-BioNTech) i 28 dni dla szczepionki Spikevax (Moderna) między dawkami podstawowymi. Dawkę przypominającą należy podać po co najmniej 3 miesiącach od podania drugiej dawki podstawowej.
Czy nastolatkom podajemy taką samą dawkę szczepionki co dorosłym?
Tak, nastolatkom podajemy taką samą dawkę szczepionki co dorosłym: Comirnaty (dawka 30 µg), Spikevax (dawka 100 µg). Różnica dotyczy wyłącznie dawki dodatkowej (trzeciej) podawanej w grupach ryzyka preparatem Spikevax (dawka 50 µg).
Dlaczego nastolatkom podajemy taka samą dawkę co dorosłym?
Ponieważ w badaniach klinicznych wykazano, że bezpieczeństwo i najwyższą skuteczność szczepienia u nastolatków zapewnia taka sama dawka jak ta podawana dorosłym.
W jakim czasie od podania innej szczepionki (np. przeciw HPV, KZM, lub błonicy, tężcowi i krztuścowi) można podać szczepionkę przeciw COVID-19?
W dowolnym czasie. Nie ma konieczności zachowania jakiegokolwiek odstępu.
W jakim czasie od szczepienia przeciw COVID-19 można podać inną szczepionkę (np. przeciw HPV, KZM, lub błonicy, tężcowi i krztuścowi)?
W dowolnym czasie. Nie ma konieczności zachowania jakiegokolwiek odstępu.
Czy taka sama dawka powinna być podana nastolatkowi, który jest niższy/mniej waży od większości swoich rówieśników?
Dawkę szczepionki dobiera się do wieku, a nie do masy ciała lub wysokości. Masa ciała nie determinuje wielkości dawki.
Czy w składzie szczepionki mRNA znajdują się substancje, które mogą być dla nastolatka niebezpieczne?
Nie ma takiej możliwości. Wszystkie składniki szczepionki zostały dokładnie sprawdzone. Występują w niewielkiej ilości, która nie stanowi zagrożenia dla organizmu.
Czy składniki szczepionek mRNA mogą powodować długoterminowe, nieznane jeszcze działania niepożądane?
Różne rodzaje szczepionek stosujemy od dziesiątek lat. Stąd też wiemy, że działania niepożądane występują w ciągu pierwszych 4-6 tyg. po szczepieniu. mRNA w szczepionce jest wyjątkowo niestabilne i ulega degradacji w ciągu 72 h od wstrzyknięcia. Podobnie inne składniki są szybko usuwane, nie pozostają w organizmie.
Czy składniki szczepionki po jej wstrzyknięciu mogą być powodem zakażenia SARS-CoV-2 u zaszczepionego nastolatka lub doprowadzić do zakażenia innej osoby?
Nie ma takiej możliwości. Szczepionka mRNA nie zawiera wirusa ani żadnych jego fragmentów. Zawiera tylko fragment informacji genetycznej o syntezie wybranego białka wirusa.
Czy skład szczepionki jest kontrolowany?
Szczepionki są kontrolowane jeszcze dokładniej niż leki. Pierwszą kontrolę przeprowadziła specjalna instytucja, która sprawdziła szczegółowo wszystkie składniki szczepionki, ich rodzaje i zawartość. Teraz każdą serię szczepionki wprowadzaną na rynek kontroluje producent szczepionki i całkowicie od niego niezależne laboratorium państwowe.
Jak długo prowadzono badania nad nową technologią szczepionki mRNA?
Prototyp szczepionki mRNA przeciw COVID-19, ten który potem sprawdzano w badaniach klinicznych na ludziach, faktycznie opracowano w ciągu kilku miesięcy. Było to możliwe, ponieważ wcześniej badacze od 20 lat pracowali nad tym, aby opracować stabilną postać mRNA, które nie ulegnie degradacji, a będzie bazą do syntezy białka (antygenu) w szczepionce.
Czy poza szczepionkami przeciw COVID-19 znamy inne szczepionki opracowane z wykorzystaniem metod biologii molekularnej?
Tak i to więcej niż byśmy podejrzewali. Rekombinowana szczepionka przeciw wirusowemu zapaleniu wątroby typu B (wzwB), która podawana jest każdemu noworodkowi już w pierwszych dniach życia. Szczepionka przeciw meningokokom grupy B chroniąca przed niebezpieczną sepsą. Szczepionka przeciw rotawirusom (zawiera reasortanty – zmienione genetycznie wirusy) podawana niemowlętom. I kilka innych.
Czy po szczepieniu przeciw COVID-19 u nastolatka mogą wystąpić działania niepożądane?
Tak, po szczepieniu przeciw COVID-19 mogą wystąpić działania niepożądane. Tak jak po podaniu innej szczepionki, leku, a nawet suplementu diety.
Jakie działania niepożądane występują najczęściej?
Zdecydowana większość działań niepożądanych to objawy łagodne lub umiarkowane, tj. obrzęk i zaczerwienie w miejscu iniekcji, gorączka, ból głowy, dreszcze, biegunka, uczucie rozbicia. Mogą niekorzystnie wpłynąć na codzienną aktywność, ale ustępują po kilku dniach.
Po której dawce możemy się spodziewać więcej działań niepożądanych?
Działania niepożądane mogą wystąpić po każdej dawce szczepionki. Więcej miejscowych i uogólnionych działań niepożądanych występuje zwykle po drugiej dawce szczepionki. Z danych monitorowania działań niepożądanych wynika, że więcej działań niepożądanych tzw. ciężkich wystąpiło po pierwszej dawce.
Czy po szczepionce mRNA mogą wystąpić ciężkie działania niepożądane?
Ciężkie działania niepożądane, które mogłyby spowodować długotrwałe problemy zdrowotne, występują bardzo rzadko i są mało prawdopodobne po jakimkolwiek szczepieniu, w tym po szczepieniu przeciw COVID-19.
Jakie jest ryzyko ciężkiego zdarzenia niepożądanego pod postacią zapalenia mięśnia sercowego?
Ryzyko jest ekstremalnie małe. Zapalenie mięśnia sercowego po szczepionkach mRNA COVID-19 zgłaszano najczęściej u mężczyzn w wieku poniżej 30 lat i zazwyczaj po drugiej dawce szczepionki. Przechorowanie COVID-19 niesie ze sobą istotnie większe ryzyko zapalenia mięśnia sercowego i innych powikłań kardiologicznych w porównaniu ze szczepieniem.
Jak długo oceniano bezpieczeństwo szczepionek mRNA?
Każda z dopuszczonych do obrotu szczepionek przeciw COVID-19 była sprawdzana w badaniach klinicznych bezpieczeństwa przez co najmniej 2 miesiące. Bezpieczeństwo szczepionek dopuszczonych do obrotu (w tym występowanie niepożądanych odczynów poszczepiennych) monitorowane jest już ponad 12 miesięcy.
Czy znamy odległe działania niepożądane po szczepieniu?
Obawy o odległe w czasie skutki działania szczepionek przeciw COVID-19 są nieuzasadnione. Miliony osób zostały zaszczepione i nie występują u nich oddalone w czasie działania niepożądane. Z wyników badań z nadzoru nad bezpieczeństwem różnych rodzajów szczepionek wiemy, że działania niepożądane występują w ciągu pierwszego miesiąca po szczepieniu.
Czy szczepionki mRNA zaburzają cykl menstruacyjny?
Zmiany cyklu menstruacyjnego po szczepieniu przeciw COVID-19 stanowią naturalną reakcję organizmu, który rozwija odpowiedź odpornościową po szczepieniu. Mają charakter tymczasowy.
Czy każdy niepokojący objaw po szczepieniu należy zgłosić lekarzowi?
Tak, wszystkie niepokojące objawy należy zgłosić swojemu lekarzowi rodzinnemu. Lekarz po badaniu stwierdzi, czy jest to niepożądany odczyn poszczepienny (NOP), czy zwykła reakcja po szczepieniu.
Czy to prawda, że nastolatek w wieku 12-15 lat może być kwalifikowany do szczepienia tylko przez lekarza?
Tak to prawda. Zaleca się, aby kwalifikację nastolatków w wieku 12-15 lat prowadził lekarz.
Czy można do szczepienia przeciw COVID-19 zarejestrować nastolatka, który w tym roku skończy 12 lat?
Na szczepienie przeciw COVID-19 można zarejestrować nastolatka, który najpóźniej w dniu przeprowadzenia szczepienia ukończy 12 lat.
Kto wypełnia kwestionariusz przed szczepieniem nastolatka w wieku 12-15 lat?
Kwestionariusz wypełnia rodzic/przedstawiciel ustawowy. Na końcu formularza podaje swoje dane i podpisem wyraża zgodę na szczepienie.
Czy potrzebna jest zgoda obojga rodziców na kwestionariuszu?
Wystarczy zgoda jednego rodzica na kwestionariuszu.


Jak działają szczepionki białkowe przeciw COVID-19?
Co to są szczepionki białkowe?
W szczepionkach białkowych wykorzystuje się te fragmenty wirusa, które zostaną rozpoznane przez układ odpornościowy i wywołują reakcję immunologiczną. Szczepionki te nie zawierają całego wirusa ani innego wirusa.
Na powierzchni koronawirusa SARS-CoV-2 znajdują się małe wypustki nazywane białkami kolca. Dzięki nim wirus wnika do komórki i wywołuje chorobę.
Szczepionki białkowe zawierają fragmenty białkowe wytworzone w laboratorium. Dzięki tym fragmentom układ odpornościowy rozpoznaje wirusa i go zwalcza. W efekcie albo choroba nie rozwija się, albo daje jedynie łagodne objawy.
Wykorzystywanie w szczepionkach fragmentów wirusa, np. białek to szeroko stosowana i ugruntowana technologia.
Co dzieje się w organizmie po podaniu szczepionki białkowej?
Szczepionka białkowa przeciw COVID-19 podawana jest drogą domięśniową. Po podaniu preparatu organizm styka się z białkiem wirusa. Układ odpornościowy wykrywa obce białko i wytwarza atakujące go przeciwciała i komórki odpornościowe. Dzięki temu organizm eliminuje obce białko.
Jeżeli dojdzie do zakażenia koronawirusem, układ odpornościowy będzie pamiętał, jak go zniszczyć.
Choroba COVID-19 nie rozwinie się lub wywoła jedynie łagodne objawy.
Szczepionki białkowe są stosowane od wielu lat i są bezpieczne. Ich produkcja jest stosunkowo łatwa. Można je przechowywać przez wiele miesięcy w lodówce (2-8▫C).
Jaka jest różnica pomiędzy szczepionką mRNA a dotychczas stosowanymi szczepionkami?
Różnica między szczepionką mRNA a dotychczas stosowanymi szczepionkami dotyczy sposobu i miejsca gdzie produkowane jest białko pełniące rolę antygenu w szczepionce. W dotychczas stosowanych szczepionkach podawaliśmy gotowe białka (antygeny) lub ich fragmenty, które stymulowały organizm do wytworzenia przeciwciał neutralizujących oraz odpowiedzi na poziomie komórkowym. W przypadku szczepionek mRNA do organizmu podajemy tylko informację genetyczną o tym jak dane białko powinno być wytworzone. Sama produkcja białka zachodzi już w naszych komórkach.
Innymi słowy w szczepionkach mRNA nie podajemy gotowego antygenu, a dokładny przepis na jego przygotowanie w postaci mRNA kodującego informację o białku pełniącym funkcję antygenu.
Szczepionka mRNA nie zawiera wirusa ani jego fragmentów. Zawiera tylko informację genetyczną (mRNA), dzięki której białko (antygen) wirusa będzie wytworzone w naszych komórkach, po podaniu szczepionki.
O szczepieniach przypominających
Po jakim czasie podajemy dawkę przypominającą szczepionki p/COVID-19?
Dawkę przypominającą szczepionki przeciw COVID-19 podajemy osobom w wieku ≥12 lat w odstępie co najmniej 3 miesiące po szczepieniu podstawowym.
Osoby zaszczepione jednodawkowym preparatem COVID-19 Vaccine Janssen (Johnson &Johnson) dawkę przypominającą powinny przyjąć po co najmniej 2 miesiącach po szczepieniu podstawowym.
W przypadku kiedy szczepienie podstawowe realizowano preparatem mRNA (Comirnaty (Pfizer-BioNTech) lub Spikevax (Moderna)) lub preparatem wektorowym Vaxzevria (AstraZeneca), jako dawka przypominająca, zalecane jest podanie szczepionki mRNA w odstępie co najmniej 3. miesięcy.
W przypadku kiedy szczepienie podstawowe realizowano preparatem wektorowym COVID-19 Vaccine Janssen jako dawkę przypominającą zalecane jest podanie szczepionki COVID-19 Vaccine Janssen lub szczepionki mRNA w odstępie co najmniej 2. miesięcy.
Jako dawkę przypominającą można stosować:
- szczepionkę mRNA Comirnaty (Pfizer-BioNTech), w pełnej dawce (30 µg) – 0,3 ml,
- szczepionkę mRNA Spikevax (Moderna) połowa dawki (50 µg) – 0,25 ml,
- szczepionkę wektorową COVID-19 Vaccine Janssen, w pełnej dawce 0,5 ml
Jako dawkę przypominającą stosujemy szczepionkę podawaną w podstawowym schemacie szczepienia lub z zachowaniem kolejności szczepienia schemat podstawowy szczepionką wektorową + dawka przypominająca szczepionki mRNA.
Szczepionka COVID-19 Vaccine Janssen może być warunkowo podana jako dawka przypominająca po szczepieniu podstawowym szczepionką mRNA z zachowaniem odstępu co najmniej 3 miesięcy po ukończeniu pełnego schematu szczepienia przeciw COVID-19.
Czy szczepionki zaktualizowane dla wariantu Omikron różnią się między sobą?
Szczepionki przeciw COVID-19 zaktualizowane dla wariantu Omikron zostały zaadaptowane w celu lepszego dopasowania do krążących wariantów SARS-CoV-2. Szczepionki te mogą zwiększyć ochronę przed nowymi wariantami, zwłaszcza przeciw wariantowi Omicron i wariantom pokrewnym.
W skład szczepionek zaktualizowanych dla wariantu Omikron wchodzi:
- mRNA oryginalnego szczepu SARS-CoV-2, ten sam, który znajduje się w oryginalnych (wyjściowych) szczepionkach przeciw COVID-19, które są stosowane od grudnia 2020 r. w programie szczepień przeciw COVID-19
oraz
- mRNA wariantu Omikron (podwariantu BA.1 lub BA4 i BA.5).
W punktach szczepień mogą być dostępne następujące szczepionki o zaktualizowanym składzie dla wariantu Omikron:
Szczepionki zaktualizowane dla podwariantu Omicron BA.1.:
- szczepionka Spikevax Bivalent Original/Omicron BA.1. (Moderna)
- szczepionka Comirnaty Original/Omicron BA.1. (Pfizer-BioNTech)
Szczepionka zaktualizowana dla podwariantu Omicron BA.4/BA.5.:
- szczepionka Comirnaty Original/Omicron BA.4/BA.5. (Pfizer-BioNtech)
Kluczowe informacje:
- Europejska Agencja Leków wydała rekomendacje, że wszystkie zatwierdzone szczepionki zaktualizowane dla wariantu Omikron rozszerzą odporność przeciw wariantom budzącym obawy, zwłaszcza wariantowi Omicron i pokrewnym podwariantom.
- Obecnie nie można wskazać, które szczepionki zaktualizowane zapewnią najwyższą ochronę, ponieważ nie można przewidzieć, jakie warianty wirusa pojawią się i będą krążyć w okresie jesienno-zimowym. Wszystkie obecnie dopuszczone do obrotu szczepionki zaktualizowane należy uznać za porównywalne.
- Nie można przewidzieć, jak wirus będzie się rozwijał w przyszłości i jakie jego warianty będą krążyły w okresie jesienno-zimowym. Nie można przewidzieć, czy wystąpią znaczące różnice w ochronie pomiędzy różnymi szczepionkami zaktualizowanymi.
- Wszystkie obecnie dopuszczone szczepionki zaktualizowane należy uznać za podobne. Nie ma większego znaczenia, którą zaktualizowaną szczepionką się zaszczepimy. Najważniejsze jest aby zaszczepić się dawką przypominającą i nie odwlekać tej decyzji. Pacjenci zgłaszający się na szczepienie powinni otrzymywać szczepionkę zaktualizowaną, która aktualnie znajduje się w posiadaniu punktu szczepień.
- Wyniki badań z zastosowaniem szczepionek zaktualizowanych dla wariantu Omicron wykazały pozytywny profil bezpieczeństwa, potwierdzoną skuteczność i jakość.
- Działania niepożądane obserwowane po zastosowaniu zaktualizowanych szczepionek były podobne do tych obserwowanych po zastosowaniu szczepionek oryginalnych i były zazwyczaj łagodne i krótkotrwałe.
Terminowe szczepienie jest ważniejsze niż to, która zaktualizowana szczepionka zostanie podana jako dawka przypominająca.

Na podstawie jakich badań zarejestrowano szczepionki przeciw COVID-19 zaktualizowane dla wariantu Omikron?
Europejska Agencja Leków pozytywnie zarekomendowała rejestrację szczepionek zaktualizowanych dla wariantu Omikron na podstawie wyników oceny ich jakości, bezpieczeństwa, immunogenności i skuteczności klinicznej:
- Ocena zaktualizowanej szczepionki Spikevax Original/Omicron BA.1 (Moderna) opierała się na wynikach badania z udziałem ponad 800 osób w wieku ≥18 lat zaszczepionych uprzednio 3 dawkami monowalentnej Spikevax (2 dawki podstawowe i 1 przypominająca). Podanie szczepionki Spikevax Original/Omicron BA.1 jako dawki przypominającej wywołało silniejszą odpowiedź immunologiczną przeciwko szczepowi SARS-CoV-2 i podwariantowi Omicron BA.1, w porównaniu z dawką przypominającą oryginalnej szczepionki Spikevax. W badaniu porównano stężenie przeciwciał u osób wcześniej zaszczepionych, serią podstawową i dawką przypominającą szczepionki Spikevax i którym podano drugą dawkę przypominającą szczepionki Spikevax lub szczepionki dwuwalentnej Spikevax Original/Omicron BA.1.
- Ocena zaktualizowanej szczepionki Comirnaty Original/Omicron BA.1 (Pfizer-BioNTech) opierała się na 2 badaniach bezpieczeństwa i immunogenności. W pierwszym uczestniczyło ponad 1800 dorosłych w wieku powyżej 55 lat, którzy otrzymali wcześniej 3 dawki szczepionki Comirnaty (szczepienie podstawowe i przypominające) skierowanej wobec wariantu oryginalnego. Wykazano, że odpowiedź immunologiczna mierzona stężeniem przeciwciał na podwariant Omicron BA.1 była wyższa po podaniu drugiej dawki przypominającej szczepionki Comirnaty Original/Omicron BA.1 niż po podaniu dawki z oryginalną szczepionką Comirnaty. W drugim badaniu uczestniczyło ponad 800 osób w wieku 18–55 lat, które uprzednio również otrzymały 3 dawki Comirnaty i otrzymano podobne wyniki.
- Wstępne dane wskazują, że odpowiedź immunologiczna indukowana przez zaktualizowane dla wariantu BA.1 szczepionki wykracza poza szczepy wchodzące w skład szczepionki i obejmuje również inne podwarianty Omicron, tj. BA.2, BA.2.75 i BA.5.
- Ocena zaktualizowanej szczepionki Comirnaty Original/Omicron BA.4-5 (Pfizer-BioNtech) opierała się na wynikach badań klinicznych bezpieczeństwa i immunogenności wcześniej zarejestrowanej szczepionki Comirnaty Original/Omicron BA.1, danych dotyczących jej jakości i procesu wytwarzania, które potwierdziły, że spełnia ona unijne normy jakości oraz danych z badań nieklinicznych na modelu zwierzęcym, gdzie wykazano, że preparat Comirnaty Original/Omicron BA.4-5 wywołuje odpowiednią odporność przeciw szczepom, na które jest ukierunkowany.
- Działania niepożądane obserwowane po zastosowaniu zaktualizowanych szczepionek były podobne do tych obserwowanych po zastosowaniu szczepionek oryginalnych i były zazwyczaj łagodne i krótkotrwałe.
- Decyzję dotyczącą stosowania zaktualizowanych szczepionek mRNA u nastolatków w wieku 12–17 lat podjęto na podstawie danych klinicznych dotyczące immunogenności i skuteczności oryginalnych szczepionek mRNA przeciwko COVID-19 w tej grupie wiekowej oraz ich podobieństwa do danych z badań dotyczących dorosłych.
Europejska Agencja Leków wydała rekomendacje, że wszystkie zatwierdzone szczepionki zaktualizowane dla wariantu Omikron rozszerzą odporność przeciw wariantom budzącym obawy, zwłaszcza wariantowi Omikron i pokrewnym podwariantom.
Obecnie nie można wskazać, które szczepionki zaktualizowane zapewnią najwyższą ochronę, ponieważ nie można przewidzieć, jakie warianty wirusa pojawią się i będą krążyć w okresie jesienno-zimowym. Wszystkie obecnie dopuszczone do obrotu szczepionki zaktualizowane należy uznać za porównywalne.
(więcej)
W jakim czasie po przechorowaniu COVID-19 można przeprowadzić kolejne szczepienie?
Szczepienie przeciw COVID-19 osób, które przebyły chorobę wywołaną zakażeniem wirusem SARS-CoV-2 (ozdrowieńcy) można rozważyć szczepienie przeciw COVID-19 w odstępie co najmniej 3 miesięcy od infekcji SARS-CoV-2.
Przebycie COVID-19 w przeszłości nie stanowi przeciwwskazania do szczepień.
Szczepienie zaktualizowaną szczepionką przeciw COVID-19 zaleca się wszystkim osobom w wieku >12 lat, niezależnie od wcześniejszego przebycia zakażenia SARS-CoV-2 (objawowego lub bezobjawowego), również osobom z przedłużającymi się objawami COVID-19.
U osób aktualnie zakażonych SARS-CoV-2 szczepienie należy opóźnić przynajmniej do momentu ustąpienia ostrych objawów choroby (jeżeli przebieg jest objawowy) i zakończenia izolacji.
U ozdrowieńców można rozważyć odroczenie szczepienia szczepionka zaktualizowaną dla podwariantu XBB1.5 o 3 miesiące od wystąpienia objawów COVID-19 lub otrzymania dodatniego wyniku badania w kierunku zakażenia SARS-CoV-2.
Badania wykazały, że wydłużenie czasu pomiędzy zakażeniem a szczepieniem może skutkować poprawą odpowiedzi immunologicznej na szczepienie. Zaobserwowano także niskie ryzyko ponownego zakażenia w ciągu tygodni lub miesięcy po zakażeniu. Przy podejmowaniu decyzji, czy opóźnić zaszczepienie się przeciwko COVID-19 po zakażeniu, należy wziąć pod uwagę indywidualne czynniki, takie jak ryzyko wystąpienia ciężkiej choroby COVID-19 lub charakterystyka dominującego szczepu SARS-CoV-2.
Schemat szczepienia przeciw COVID-19 osób z zaburzeniami odporności
Osoby z chorobami towarzyszących, np. onkologicznymi lub z powodu przyjmowanych leków immunosupresyjnych mogą słabiej odpowiadać na szczepienie.
Osoby z zaburzeniami odporności powinny zostać zaszczepione 3 dawkami szczepionki w schemacie podstawowym oraz dwoma dawkami przypominającymi (łącznie 5 dawek szczepionki).
Osoby z ciężkimi zaburzeniami odporności:
- wynikającymi z leczenia przeciwnowotworowego,
- po przeszczepie,
- z umiarkowanym lub ciężkim zespołem pierwotnych niedoborów odporności,
- zakażone wirusem HIV,
- leczone dużymi dawkami kortykosteroidów lub lekami hamującymi odpowiedź immunologiczną,
- dializowane przewlekle z powodu niewydolności nerek,
należą do grupy ryzyka ciężkiego przebiegu COVID-19. Ze względu na chorobę podstawową mogą słabiej odpowiadać na szczepienie przeciw COVID-19 i odpowiedź odpornościowa na podstawowe szczepienie (2 lub 1 dawka w zależności od preparatu) w tej grupie, z wysokim prawdopodobieństwem jest niewystarczająca.
Stąd też zaleca się aby osoby ze wskazanych grup ryzyka były szczepione przeciw COVID-19 w schemacie, który obejmuje podanie łącznie 5 dawek szczepionki:
szczepienie podstawowe:
- 2 dawki podane zgodnie ze wskazaniami dla wieku,
- dawka dodatkowa (inaczej uzupełniająca) podana po co najmniej 28 dniach od drugiej dawki szczepionki.
szczepienie przypominające:
- 1. dawka podana po co najmniej 3 miesiącach od podania dawki dodatkowej,
- 2. dawka podana po co najmniej 3 miesiącach od podania pierwszej dawki przypominającej.
Dodatkową dawkę stosuje się we wskazanych grupach z zachowaniem odstępu co najmniej 28 dni po zakończeniu realizacji schematu szczepienia pierwotnego przeciw COVID-19.
- podajemy szczepionkę Comirnaty (Pfizer-BioNTech) (pełna dawka 30 µg- 0,3 ml)
- lub szczepionkę Spikevax (Moderna) (pełna dawka 100 µg- 0,5 ml), z uwzględnieniem w pierwszej kolejności podania szczepionki determinowanej szczepieniem podstawowym,
Jako dawkę przypominającą u osób z zaburzeniami odporności w wieku ≥ 12 lat można stosować szczepionki:
- Comirnaty (Pfizer-BioNTech) (pełna dawka 30 µg- 0,3 ml)
- Spikevax (Moderna) (połowa dawki 50 µg- 0,25 ml)
Osoby z ciężkimi zaburzeniami odporności szczepione są z wyboru szczepionkami mRNA. Szczepionka COVID-19 Vaccine Janssen może być jedynie warunkowo podana jako heterologiczna dawka przypominająca po szczepieniu podstawowym z dawką dodatkową, wykonanym szczepionką mRNA przeciw COVID-19 u osób powyżej 18 r.ż.
Szczepienia u osób z zaburzeniami odporności są dobrze tolerowane. Rodzaje i częstość występowania działań niepożądanych po szczepieniu jest podobna jak w ogólnej populacji.
Nie ustalono przydatności testów serologicznych do oceny odpowiedzi immunologicznej na szczepienie. Nie zaleca się wykonywania badań serologicznych w celu oceny odpowiedzi na szczepienie przed podaniem dawki dodatkowej oraz przypominającej.

Jakie najdłuższe odstępy pomiędzy podaniem dwóch dawek szczepionki przeciw COVID-19 można zastosować?
W odniesieniu do całego programu szczepień ochronnych przeciw COVID-19 najdłuższy odstęp czasu dla podania szczepionki Comirnaty (Pfizer BioNTech) i szczepionki Spikevax (Moderna) wynosi 42 dni (jest zgodny z maksymalnym terminem, w którym podawano drugą dawkę szczepionki w badaniach klinicznych. W przypadku szczepionki Vaxzevria (AstraZeneca) najdłuższy odstęp czasu pomiędzy dawkami to 84 dni (zgodnie z zapisem w Charakterystyce Produktu Leczniczego).
Jednak w sytuacjach indywidualnych, kiedy z różnych powodów, np. związanych z przeciwwskazaniami medycznymi lub z powodów organizacyjnych drugiej dawki szczepionki nie podano w ww terminie, należy postępować zgodnie z ogólnymi zasadami dotyczącymi realizacji szczepień ochronnych:
• każda podana dawka szczepionki jest ważna,
• nie rozpoczynamy przerwanego schematu szczepienia od początku,
• uzupełniamy brakującą dawkę szczepionki w pierwszym możliwym terminie, nawet jeżeli odstęp jest dłuższy niż ww.
Zakończenie zalecanego schematu szczepienia, tj. podania 2 dawek szczepionki Comirnaty (Pfizer BioNTech), szczepionki Spikevax (Moderna) oraz szczepionki Vaxzevria (AstraZeneca) jest bardzo ważne, szczególnie w odniesieniu do uzyskania możliwie najlepszej ochrony przed zakażeniem i objawami choroby wywołanej przez wariant Delta wirusa SARS-CoV-2.
Czy należy zachować odstęp czasu pomiędzy szczepieniem przeciw COVID-19 a innym szczepieniem?
Każdą szczepionkę można podać w dowolnym czasie od szczepienia przeciw COVID-19. Nie ma konieczności zachowania jakiegokolwiek odstępu pomiędzy szczepieniami.
Zgodnie z wytycznymi Amerykańskiej Akademii Pediatrii (American Academy of Pediatrics), Centrum Kontroli i Zapobiegania Chorób (Centers for Disease Control and Prevention) oraz lokalnymi wytycznymi kilku krajów w Europie dotyczącymi podawania szczepionek przeciw COVID-19 z innymi szczepionkami, nie ma konieczności zachowania określonego odstępu pomiędzy szczepieniem przeciw COVID-19 oraz innymi szczepieniami. Dotyczy to zarówno szczepień dzieci jak i szczepień dorosłych.
W przypadku szczepień przeciw grypie i szczepień przeciw COVID-19 eksperci wręcz zalecają ich podawanie w czasie tej samej wizyty szczepiennej.
Nie ma konieczności zachowania odstępu czasowego pomiędzy szczepieniem przeciw grypie, a jakimkolwiek innym szczepieniem.
Szczepionki przeciw COVID-19 można podawać w dowolnym czasie przed lub po podaniu innych szczepionek.
Eksperci rekomendują jednoczesne (w czasie jednej wizyty, w dwie różne kończyny) szczepienia przeciw COVID-19 i przeciw grypie wszystkimi dostępnymi na rynku szczepionkami dla danej grupy wiekowej.
W przypadku wątpliwości (np. wystąpienia działań niepożądanych po poprzednich dawkach) należy rozważyć zachowanie bezpiecznego odstępu pomiędzy szczepieniami.
Na początku realizacji programu szczepień przeciw Covid-19 zalecano zachowanie ≥14 dni odstępu pomiędzy podaniem szczepionki przeciw Covid-19 oraz innymi szczepionkami. Wynikało to z ostrożności, a nie z uwagi na jakiekolwiek znane obawy dotyczące wpływu na bezpieczeństwo lub immunogenność szczepionki. Odstęp 14 dni wynikał z procedury badania klinicznego, gdzie takie postępowanie obowiązywało. Szczepionki przeciw COVID-19, tak mRNA jak i wektorowe, nie zawierają zdolnego do replikacji wirusa. Można w ich przypadku zastosować ogólne wymagania dotyczące podawania szczepionek, zgodnie z którymi wymagany odstęp czasu 28 dni, dotyczy jedynie sytuacji, kiedy podajemy dwie żywe szczepionki.
O bezpieczeństwie
Jakie działania niepożądane mogą wystąpić po białkowej szczepionce Nuvaxovid?
W badaniach klinicznych białkowej szczepionki Nuvaxovid najczęściej zgłaszanymi miejscowymi niepożądanymi odczynami poszczepiennymi (NOP) były ból/tkliwość w miejscu wstrzyknięcia, rzadziej zgłaszano zaczerwienienie i obrzęk. Najczęściej zgłaszanymi ogólnoustrojowymi NOP były: zmęczenie i gorsze samopoczucie, ból głowy i mięśni. Większość z nich miała łagodne lub umiarkowane nasilenie i ustępowała do 3 dni po szczepieniu. NOP częściej obserwowano u osób w wieku 12-64 lata niż w wieku ≥65 lat oraz po drugiej dawce szczepionki. U osób w wieku ≥18 lat miejscowe i ogólnoustrojowe NOP obserwowano częściej po podaniu dawki przypominajacej szczepionki Nuvaxovid niż po drugiej dawce schematu podstawowego.
Działania niepożądane które mogą wystąpić po szczepionce mRNA
Po podaniu szczepionki mRNA przeciw COVID-10 mogą wystąpić:
- miejscowe niepożądane odczyny poszczepienne (NOP) (np. ból, obrzęk, zaczerwienienie w miejscu wkłucia, powiększenie okolicznych pachowych węzłów chłonnych po stronie wstrzyknięcia, lub NOP ogólnoustrojowe (np. gorączka, zmęczenie, ból głowy, dreszcze, ból mięśni lub stawów),
- większość ogólnoustrojowych NOP ma charakter łagodny lub umiarkowany, pojawia się w ciągu pierwszych 3 dni po szczepieniu i ustępuje w ciągu 1–2 dni,
- NOP występują częściej i są bardziej nasilone po podaniu drugiej dawki szczepionki oraz u osób młodszych niż u starszych,
- u ozdrowieńców, niektóre NOP (gorączka, dreszcze, ból mięśni) mogą występować częściej po pierwszej dawce szczepionki.
Szczepionka Comirnaty (Pfizer-BioNTech)
Najczęstsze działania niepożądane (zgłoszone w badaniach klinicznych):
- ból w miejscu wstrzyknięcia (>80%),
- zmęczenie (>60%),
- ból głowy (>50%),
- ból mięśni i dreszcze (>30%),
- ból stawów (>20%),
- gorączka i obrzęk w miejscu wstrzyknięcia (>10%).
Działania te miały zazwyczaj nasilenie łagodne lub umiarkowane oraz ustępowały w ciągu 1-2 dni od podania szczepionki.
U osób w podeszłym wieku występowało mniej działań niepożądanych.
Charakterystyce Produktu Leczniczego dla lekarza oraz Ulotce dla pacjenta
Szczepionka Spikevax (Moderna)
Najczęstsze działania niepożądane (zgłoszone w badaniach klinicznych):
- ból w miejscu wstrzyknięcia (92%),
- zmęczenie (70%),
- ból głowy (64,7%),
- ból mięśni (61,5%),
- ból stawów (46,4%),
- dreszcze (45,4%),
- nudności/wymioty (23%),
- obrzęk/tkliwość pod pachą(19,8%),
- gorączka (15,5%),
- obrzęk w miejscu wstrzyknięcia (14,7%)
- zaczerwienienie (10%)
Większość miejscowych i ogólnoustrojowych działań niepożądanych miała nasilenie łagodne lub umiarkowane i ustępowały w ciągu 1-2 dni po szczepieniu. Nieco mnie działań niepożądanych odnotowano u osób w podeszłym wieku.
Niektóre działania niepożądane występowały częściej w młodszych grupach wiekowych. Częstość występowania obrzęku/tkliwości pod pachą, zmęczenia, bólu głowy, bólu mięśni, bólu stawów, dreszczy, nudności/wymiotów i gorączki była większa u osób dorosłych w wieku od 18 do <65 lat niż u osób w wieku 65 lat i starszych.
Miejscowe i ogólne działania niepożądane były zgłaszane częściej po podaniu 2 dawki niż po podaniu 1 dawki.
Charakterystyka Produktu Leczniczego dla lekarza oraz Ulotka dla pacjenta.
- U niektórych osób w okresie po szczepieniu preparatami mRNA (tj. Pfizer/BioNTech, Moderna) odnotowano przypadki zapalenia mięśnia sercowego lub osierdzia. Zdarzenia te najczęściej występowały w ciągu kilku dni po podaniu drugiej dawki szczepionki, głównie u chłopców i młodych mężczyzn, w wieku 12-29 lat. Występowały z ekstremalnie niską częstością. Większość pacjentów wymagała hospitalizacji, w trakcie której ustępowały ostre objawy choroby. Mechanizm rozwoju zapalenia mięśnia sercowego lub osierdzia w okresie po szczepieniu preparatami mRNA nie jest dokładnie poznany.
- Jeżeli po podaniu szczepionki mRNA wystąpi którykolwiek z takich objawów, jak: ból w klatce piersiowej, duszność, uczucie szybkiego bicia serca, trzepotania lub kołatania serca, należy natychmiast zgłosić się do lekarza,
- Wszystkie przypadki zapalenia mięśnia sercowego lub osierdzia, które wystąpią w okresie po szczepieniu COVID-19 należy zgłaszać do systemu rejestracji NOP.
- Eksperci podkreślają, że KORZYŚCI ze szczepienia przeciw COVID-19 preparatami mRNA zdecydowanie przeważają ryzyko związane z występowaniem zapalenia mięśnia sercowego i zapalenia osierdzia po szczepieniu. Dotyczy to populacji objętej szczepieniami, tj. osób ≥12 lat preparatem Pfizer – BioNTech oraz osób ≥18 lat preparatem Moderna.
Co warto wiedzieć o występowaniu zapalenia mięśnia sercowego po szczepieniu przeciw COVID-19 preparatem mRNA?
- Wśród osób, które otrzymały szczepionkę mRNA przeciw COVID-19, w tym Comirnaty (Pfizer-BioNTech) i Spikevax (Moderna), zaobserwowano nieznaczne zwiększenie ryzyka wystąpienia zapalenia mięśnia sercowego lub zapalenia osierdzia w porównaniu z osobami nieszczepionymi.
- Sama choroba COVID-19 wiąże się z istotnie większym ryzykiem zapalenia mięśnia sercowego i innych powikłań kardiologicznych niż szczepienie.
- Grupy ekspertów i oficjalne instytucje jak WHO, CDC, EMA, ECDC podkreślają, że korzyści ze szczepienia chroniącego przed COVID-19 znacznie przewyższają rzadkie ryzyko zapalenia mięśnia sercowego lub osierdzia. Comirnaty i Spikevax są nadal zalecane młodzieży w wieku 12 lat i starszym oraz wszystkim osobom dorosłym.
- Wystąpienie zapalenia osierdzia i mięśnia sercowego po szczepionkach mRNA COVID-19 zgłaszano najczęściej u mężczyzn w wieku poniżej 30 lat i zazwyczaj po drugiej dawce szczepionki.
- Większość przypadków zapalenia mięśnia sercowego i osierdzia związanych ze szczepionką mRNA miała łagodny przebieg i pacjenci szybko wracali do zdrowia. Nadal trwają długoterminowe obserwacje przebiegu choroby.
- Szczepionki wektorowe Vaxzevria (AstraZeneca) ani COVID-19 Vaccine Janssen nie powodują zwiększonego ryzyka wystąpienia zapalenia mięśnia sercowego lub osierdzia. Chociaż zgłaszano przypadki zachorowań po podaniu tej szczepionki, nie były one zgłaszane częściej niż można by się tego spodziewać w przypadku braku szczepień.
- Występujące wcześniej schorzenia kardiologiczne nie są uważane za przeciwwskazanie do szczepienia przeciw COVID-19.
- Osoby, u których w przeszłości występowały którekolwiek z poniższych schorzeń sercowo-naczyniowych, mogą otrzymać szczepionkę mRNA (Comirnaty lub Spikevax), ale powinny skonsultować się z lekarzem rodzinnym, wakcynologiem lub kardiologiem w sprawie najlepszego terminu szczepienia oraz tego, czy zalecane są dodatkowe środki ostrożności:
- niedawno przebyte (tj. w ciągu ostatnich 3 miesięcy) zapalenie mięśnia sercowego lub osierdzia,
- ostra gorączka reumatyczna lub ostra reumatyczna choroba serca (tj. z oznakami aktywnego stanu zapalnego),
- zdekompensowana niewydolność serca.
- Objawy zapalenia mięśnia sercowego lub osierdzia pojawiają się zwykle w ciągu 1-5 dni po podaniu drugiej dawki szczepionki mRNA i mogą obejmować ból w klatce piersiowej, kołatanie serca (nieregularne bicie serca), omdlenia (zasłabnięcia) lub duszności. Osoby, u których wystąpi którykolwiek z tych objawów po podaniu szczepionki mRNA przeciw COVID-19, powinny niezwłocznie zwrócić się po pomoc medyczną.
- W zależności od stopnia ciężkości klinicznej i ryzyka, niektórzy pacjenci mogą wymagać kontroli na oddziale ratunkowym lub pobytu w szpitalu, a niektórym wystarczy porada ambulatoryjna.
- Wstępne badania powinny obejmować EKG i oznaczenie stężenia troponiny we krwi. Pozostałe badania diagnostyczne, w tym badanie radiologiczne klatki piersiowej i inne badania w celu wykluczenia innych przyczyn powinny być wykonane zgodnie ze wskazaniami klinicznymi.
- Zalecenia dotyczące ewentualnych dawek przypominających szczepionki w przyszłości różnią się w zależności od wyników badań:
- kolejne dawki szczepionki mRNA przeciwko COVID-9 można podać osobom, u których podejrzewano zapalenie osierdzia, ale u których stwierdzono prawidłowe wyniki EKG, troponiny i markerów stanu zapalnego oraz u których przez co najmniej 6 tygodni nie wystąpiły żadne objawy. Dotyczy to również osób z klinicznym rozpoznaniem zapalenia osierdzia pomimo prawidłowych wyników badań.
- u osób, u których potwierdzono zapalenie mięśnia sercowego przypisywane szczepionce Comirnaty lub Spikevax, powinno się odroczyć podanie kolejnych dawek szczepionki mRNA przeciwko COVID-19, a jeśli są w wieku > 18 lat, można w indywidualnych przypadkach rozważyć szczepionkę Vaxzevria, po wyzdrowieniu z objawów.
Szczepionka mRNA przeciw COVID-19, jak każda szczepionka może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Szczepionka wektorowa AstraZeneca: Jakie działania niepożądane mogą wystąpić?
Działania niepożądane Vaxzevria (AstraZeneca)
Najczęstsze działania niepożądane obserwowane po podaniu szczepionki Vaxzevria (AstraZeneca):
- tkliwość w miejscu wstrzyknięcia (63,7%),
- ból w miejscu wstrzyknięcia (54,2%),
- ból głowy(52,6%),
- zmęczenie (53,1%),
- ból mięśni(44,0%),
- złe samopoczucie (44,2%),
- uczucie gorączki (33,6%),
Najczęstsze działania niepożądane obserwowane po podaniu szczepionki COVID-19 Vaccine Janssen:
- ból w miejscu wstrzyknięcia (48,6%),
- ból głowy (38,9%),
- zmęczenie (38,2%),
- ból mięśni (33,2%),
- nudności (14,2%).
- gorączka (9%).
Większość działań niepożądanych wystąpiła w ciągu 1-2 dni po szczepieniu i miały one nasilenie łagodne do umiarkowanego oraz trwały krótko (1-2 dni).
NOP były łagodniejsze i występowały rzadziej u osób w podeszłym wieku.
Charakterystyka Produktu Leczniczego oraz Ulotka dla pacjenta.
Co wynika z badań bezpieczeństwa szczepionki wektorowej AstraZeneca?
W badaniach klinicznych, gdzie oceniano bezpieczeństwo szczepionki AstraZeneca wzieło udział 23 745 osób. Zdarzenia niepożądane, w tym ciężkie zdarzenia niepożądane występowały z podobną częstością, w grupie badanej i grupie kontrolnej, odpowiednio 0,8% vs 1,1% i 0,7% vs 0,8%.
Ogółem odnotowano 175 ciężkich zdarzeń niepożądanych, w tym 84 w grupie badanej i 91 w grupie kontrolnej. Z analizy wynika, że 3 z nich mogły mieć związek z podaniem szczepionki badanej lub kontrolnej:
- przypadek niedokrwistości hemolitycznej w grupie kontrolnej, który wystąpił 10 dni po podaniu szczepionki przeciw meningokokom MenACWY podawanej w grupie kontrolnej,
- przypadek poprzecznego zapalenia rdzenia w grupie badanej, który wystąpił 14 dni po podaniu drugiej dawki szczepionki AstraZeneca (z analizy niezależnego zespołu eksperckiego neurologów wynika, że najbardziej prawdopodobnym rozpoznaniem jest idiopatyczna krótkosegmentowa demielinizacja rdzenia kręgowego),
- przypadek gorączki >40°C, która wystąpiła 2 dni po podaniu szczepionki badanej lub kontrolnej; pacjent nie wymagał hospitalizacji i w krótkim czasie całkowicie powrócił do zdrowia.
Niezależny zespół neurologów ocenił również dwa przypadki poprzecznego zapalenia rdzenia, które wystąpiły po szczepieniu i były bezpośrednim powodem okresowego wstrzymania badań klinicznych szczepionki AstraZeneca we wrześniu 2020 roku. Jedna osoba miała zidentyfikowane przed szczepieniem stwardnienie rozsiane. U drugiej osoby wystąpienie poprzecznego zapalenia rdzenia nie miało związku ze szczepieniem.
Wszystkie osoby, u których wystąpiły ciężkie zdarzenia niepożądane po podaniu szczepionki AstraZeneca, całkowicie wyzdrowiały, są w stanie stabilnym lub okresie poprawy.
Jakie działania niepożądane mogą wystąpić po wektorowej szczepionce AstraZeneca?
Gdzie można zgłosić NOP po szczepieniu przeciw COVID-19?
NOP po szczepieniu przeciw COVID-19 można zgłosić do:
- lekarza, który po rozpoznaniu NOP zgłasza go do inspekcji sanitarnej (elektronicznie za pośrednictwem aplikacji gabinet.gov.pl). Od 6 stycznia 2021 roku obowiązuje rozporządzenie Ministra Zdrowia z dnia 31 grudnia 2020 roku zmieniające rozporządzenie w sprawie niepożądanych odczynów poszczepiennych oraz kryteriów ich rozpoznawania (Dz.U. z 2020 r. poz.13), gdzie wskazano zmienioną drogę przesyłania zgłoszenia podejrzenia lub rozpoznania NOP i sposób gromadzenia tych zgłoszeń przez właściwe organy inspekcji sanitarnej. Rozporządzenie to wprowadza również nowy wzór karty zgłoszenia NOP, która uwzględnia szczepienie przeciwko COVID-19.
- każdy może zgłosić działanie niepożądane do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl
- każdy może zgłosić działanie niepożądane bezpośrednio do podmiotu odpowiedzialnego (dane kontaktowe podane są na ulotce dla pacjenta danej szczepionki).
Gdzie można znaleźć informacje na temat liczby NOP zgłoszonych po szczepieniach przeciw COVID-19?
Informacje o liczbie i rodzaju niepożądanych odczynów poszczepiennych (NOP) po szczepieniach przeciw COVID-19, zgłoszonych przez lekarzy do Państwowej Inspekcji Sanitarnej można znaleźć w 2 miejscach:
- na stronie Szczepimysie poświęconej programowi szczepień przeciw COVID-19, gdzie dostępne są bieżące raporty dotyczące niepożądanych odczynów poszczepiennych zgłoszonych po szczepieniach przeciw COVID-19.
- Na stronie NIZP PZH-PIB dostępne są okresowe wyniki analizy NOP.
Analiza obejmująca okres 27.12.2020-27.12.2021.
Aktualna analiza obejmuje okres od 27.12.2020 do 15.01.2022 (80% zarejestrowanych zgłoszeń). Wykonano 49 264 863 szczepień przeciw COVID-19. Zgłoszono 17 528 niepożądanych odczynów poszczepiennych (NOP) i niepożądanych zdarzeń medycznych (NZM). Częstość zgłoszonych NOP i NZM ogółem wynosi 0,05%.

Co mówią nam dotychczasowe wyniki badań klinicznych 3 fazy szczepionek mRNA przeciw COVID-19?
Z upływem czasu poznajemy kolejne wyniki badań skuteczności klinicznej dwóch dostępnych na rynku szczepionek mRNA przeciw COVID-19 : Comirnaty (Pfizer-BioNTech) i Spikevax (Moderna). Obie szczepionki sprawdzono w randomizowanych badaniach kontrolowanych z grupą placebo (badania kliniczne 3 fazy). Badania te prowadzono na dużych grupach ochotników. W badaniach uczestniczyli reprezentatywni przedstawiciele populacji pod względem wieku, płci, rasy, pochodzenia (więcej o badaniach klinicznych).
Szczepionka mRNA Comirnaty (Pfizer-BioNTech), nazwa szczepionki w badaniach klinicznych BNT162b2 mRNA
Szczepionka Comirnaty (Pfizer-BioNTech) została dopuszczona do obrotu w Unii Europejskiej w procedurze warunkowej 21 grudnia 2020 roku. Ocena bezpieczeństwa i skuteczności szczepionki podawanej w schemacie 2 dawek w odstępie 21 dni (wielkość dawki 30 µg) bazowała na wynikach dużego randomizowanego, zaślepionego badania klinicznego 3 fazy, w którym uczestniczyło 44 165 osób w wieku ≥16 lat, przydzielonych losowo do jednej z 2 grup: badanej i kontrolnej.
W okresowej analizie (po ponad 2 miesiącach obserwacji), której wyniki oceniano w procesie dopuszczenia do obrotu, potwierdzono:
- 95,0% (95% CI: 90,3-97,6) w ochronie przed objawami COVID-19.
Opublikowane wyniki tej analizy: Polack F.P. i wsp. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020; 383:2603-2615
Kolejne wyniki skuteczności klinicznej po 6 miesiącach obserwacji:
- 91,3% (95% CI: 89,0-93,2) w ochronie przed objawami COVID-19,
- 96,7% (95% CI: 80,3-99,9) w ochronie przed ciężkimi objawami COVID-19,
- nie zidentyfikowano żadnych nowych sygnałów alarmowych dotyczących bezpieczeństwa.
W kontrolowanym badaniu klinicznym 3 fazy potwierdzono utrzymywanie się wysokiej skuteczności szczepionki Comirnaty (Pfizer-BioNTech) w ochronie przed objawami COVID-19.
Opublikowane wyniki tej analizy: Thomas S.J. i wsp. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine through 6 Months. N Engl J Med 2021; 385:1761-1773
Szczegółowy opis badania klinicznego: ClinicalTrials.gov no. NCT04368728
Szczepionka mRNA Spikevax (Moderna), nazwa w badaniach klinicznych mRNA-1273
Szczepionka Spikevax (Moderna) została dopuszczona do obrotu w Unii Europejskiej w procedurze warunkowej 6 stycznia 2021 roku. Ocena bezpieczeństwa i skuteczności szczepionki podawane w schemacie 2 dawek w odstępie 28 dni (wielkość dawki 100 µg) bazowała na wynikach dużego randomizowanego, zaślepionego badania klinicznego 3 fazy, w którym uczestniczyło 30 415 osób w wieku od 18 do 94 lat, przydzielonych losowo do jednej z 2 grup: badanej i kontrolnej.
W okresowej analizie (po 64 dniach obserwacji), której wyniki oceniano w procesie dopuszczenia do obrotu, potwierdzono:
- 94,1% (95% CI: 89,3-96,8) ochrony przed objawami COVID-19
Opublikowane wyniki tej analizy: Baden L.R. i wsp. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. NEJM. 30 December 2020.
Po 5,3 miesiącach obserwacji uczestnicy badania z grupy kontrolnej zostali poinformowani o wynikach i zaproponowano im szczepienie przeciw COVID-19.
Pod koniec zaślepionej fazy badania uzyskano następujące wyniki skuteczności klinicznej szczepionki:
- 93,2% (95% CI: 91,0-94,8) w ochronie przed objawami COVID-19,
- 98,2% (95% CI: 92,8-99,6) w ochronie przed ciężkimi objawami COVID-19,
- 63,0% (95% CI: 56,6-68,5) w ochronie przed bezobjawowym zakażeniem,
- nie zidentyfikowano żadnych nowych sygnałów alarmowych dotyczących bezpieczeństwa.
W badaniu klinicznym 3 fazy potwierdzono utrzymywanie się wysokiej skuteczności szczepionki Spikevax (Moderna) w ochronie przed objawami COVID-19.
Opublikowane wyniki tej analizy: Sahly H.E. i wsp. Efficacy of the mRNA-1273 SARS-CoV-2 Vaccine at Completion of Blinded Phase. N Engl J Med 2021; 385:1774-1785
Szczegółowy opis badania klinicznego: ClinicalTrials.gov no NCT04470427
Jakie są podobieństwa i różnice pomiędzy opracowanymi szczepionkami mRNA przeciw COVID-19?
Stosowane w programie szczepień przeciw COVID-19 szczepionki mRNA, tj. szczepionka Comirnaty i szczepionka Moderna mają taki sam mechanizm działania oraz porównywalny skład jakościowy.
Dwie szczepionki zawierają fragment mRNA (ze zmodyfikowanymi nukleozydami), który koduje informację o syntezie białka S nowego koronawirusa SARS-CoV-2.
Obie szczepionki zbadano w dużych badaniach klinicznych: Comirnaty (43 000 ochotników), Moderna (30 000 ochotników). Uzyskano wysoką skuteczność: Comirnaty (95%), Moderna (94,1%). Szczepionki reprezentują podobny profil bezpieczeństwa, najczęstsze działania to ustępujące w ciągu 1-2 dni: ból w miejscu wstrzyknięcia, zmęczenie, ból głowy, ból mięśni, dreszcze, bóle stawów, gorączka.
Szczepionki mają również podobne zapisy dotyczące przeciwwskazań i środków ostrożności.
Szczepionki różnią się wskazaniami dotyczącymi wieku: Comirnaty może być podawana osobom od 16 lat, Moderna osobom od 18 lat.
Obie szczepionki podawane są w schemacie 2 dawek. Różnią się zalecanym odstępem czasu pomiędzy podaniem 2 dawek: Comirnaty (21 dni), Moderna (28 dni).
Szczepionki różnią się wielkością opakowania. Z 1 fiolki szczepionki Comirnaty można uzyskać po odtworzeniu 6 dawek, a z 1 fiolki Moderny można uzyskać 10 dawek.
Różnica dotyczy objętości i zawartości dawki: Comirnaty (0,3 ml; 30 mikrograma szczepionki) Moderna (0,5 ml; 100 mikrograma szczepionki).
Najistotniejsza różnica dotyczy przechowywania szczepionki i warunków łańcucha chłodniczego. Szczepionkę Comirnaty można przechowywać 6 miesięcy w temp. -90⸰C do -60⸰C, po wyjęciu z zamrażarki do 5 dni w temp. 2⸰C-8⸰C. Szczepionkę Moderna można przechowywać 7 miesięcy w temp. – 25⸰C do -15⸰C, po wyjęciu z zamrażarki do 30 dni w temp. 2⸰C do 8⸰C.
Niewielka różnica pomiędzy szczepionkami dotyczy również substancji pomocniczych, w tym rodzaju lipidów tworzących kapsułkę, w której zamknięte jest mRNA. Dobór lipidów wpływa na stabilność mRNA, co w przypadku szczepionki Moderna pozwala na jej przechowywanie w wyższych temperaturach w porównaniu do szczepionki Comirnaty.

Aktualną Charakterystykę Produktu Leczniczego oraz ulotkę dla pacjenta dwóch szczepionek mRNA przeciw COVID-19 zarejestrowanych w Unii Europejskiej znajdziemy na stronie Europejskiej Agencji Leków:
Skład szczepionek mRNA przeciw COVID-19: Pfizer i BioNTech
W szczepionkach mRNA przeciw COVID-19 występuje fragment kwasu nukleinowego mRNA, który zawiera informację o syntezie białka S wirusa SARS-CoV-2. W szczepionce nie znajdziemy wirusa ani jego białek. Szczepionka mRNA ma mniej substancji pomocniczych w porównaniu z tradycyjnymi szczepionkami dostępnymi na rynku. Wśród substancji pomocniczych znajdziemy: nanocząsteczki lipidowe, sole, cukier i woda.
1 dawka szczepionki mRNA zawiera 30 mikrogramów i 100 mikrogramów odpowiednio szczepionki Comirnaty (Pfizer-BioNTech) i szczepionki Spikevax (Moderna) zawartej w kapsułce z nanocząsteczek lipidowych.
Szczepionka mRNA zawiera cztery rodzaje substancji:
- SUBSTANCJĘ CZYNNĄ: mRNA kodujący białko S (kolca) wirusa SARS-CoV-2, pełniące funkcję ANTYGENU.
- TŁUSZCZE w postaci nanocząsteczek lipidowych: 4 rodzaje tłuszczów (lipidów), które tworzą małe nierozpuszczalne w wodzie cząsteczki. Ich zadanie polega na stabilizacji mRNA i jego ochronie przed degradacją, ułatwieniu transportu mRNA do komórek docelowych oraz wzmocnieniu odpowiedzi odpornościowej (działają jak swego rodzaju adiuwant).
- SOLE, które są dodawane aby utrzymać odpowiednie pH szczepionki.
- SACHAROZĘ, czyli cukier zapobiega zlepianiu się i przywieraniu cząstek lipidów.
- WODĘ
Szczegółowy skład szczepionek przeciw COVID-19.
W związku z tym, że w szczepionkach mRNA przeciw COVID-19 nie ma żadnych wirusów, ani białek wirusów, dlatego w procesie ich wytwarzania nie ma konieczności stosowania linii komórkowych, antybiotyków lub innych substancji dodawanych do podłoży hodowlanych. W szczepionkach mRNA nie ma również konserwantów (tj. tiomersal) ani adiuwantów.
Szczepionki mRNA nie zawierają żadnych białek, więc obawy o alergie na białko jaja kurzego lub gluten są nieuzasadnione.
W szczepionkach wektorowych przeciw COVID-19 występuje niezjadliwy adenowirus (ludzki lub zwierzęcy), z wbudowaną informacją genetyczną o syntezie białka S wirusa SARS-CoV-2 (antygenu). Wirus pełni funkcje wektora, odpowiedzialnego za transport fragmentu genetycznego w szczepionce.
Wektor wirusowy został wcześniej w laboratorium zmieniony w taki sposób, że nie może się replikować i nie wywołuje objawów chorobowych. Szczepionka wektorowa ma mniej substancji pomocniczych w porównaniu z tradycyjnymi szczepionkami dostępnymi na rynku. Wśród substancji pomocniczych znajdziemy: nanocząsteczki lipidowe, sole, cukier i woda.
Szczepionka wektorowa zawiera cztery rodzaje substancji:
- SUBSTANCJĘ CZYNNĄ: wektor wirusa z wbudowanym genem białka S wirusa SARS-CoV-2, pełniącego funkcję ANTYGENU
- SOLE, które są dodawane aby utrzymać odpowiednie pH szczepionki
- POLISORBAT 80 pełniący funkcję stabilizującą
- WODĘ
Szczegółowy skład szczepionek przeciw COVID-19.
W procesie wytwarzania szczepionek wektorowych adenowirusy hodowane są w liniach komórkowych wyprowadzonych z materiału pochodzącego od człowieka.
W szczepionkach wektorowych nie ma konserwantów ani adiuwantów.
Zestawienie szczepionek przeciw COVID-19 (antygeny + substancje pomocnicze).
Program Szczepień przeciw COVID-19
Program Szczepień przeciw COVID-19
Program Szczepień przeciw COVID-19 służy zaplanowaniu działań, które mają zagwarantować przeprowadzenie bezpiecznych i skutecznych szczepień wśród obywateli Polski. Obejmuje nie tylko zakup odpowiedniej liczby szczepionek, ich dystrybucję, ale także monitoring przebiegu i efektywności szczepienia oraz bezpieczeństwo Polaków.
Podstawowym celem zaprezentowanym w programie jest dostarczenie szczepionek:
- bezpiecznych i skutecznych,
- w wystarczającej ilości,
- w najkrótszym czasie,
- darmowych,
- dobrowolnych,
- łatwo dostępnych.
Dokument opisuje m.in. grupy priorytetowe, które będą objęte szczepieniami w pierwszej kolejności, proces zakupów i finansowanie szczepionek, dystrybucję i logistykę oraz organizację punktów szczepień.
Pełny dokument Narodowy Program Szczepień.
Więcej informacji na temat szczepień przeciw COVID-19 dostępna jest na oficjalnej stronie Szczepimysię.pl.
Kwestionariusz przed szczepieniem przeciw COVID-19 dla pacjenta
Kwestionariusz wstępnego wywiadu przesiewowego przed szczepieniem osoby dorosłej przeciw COVID-19 dostępny jest na oficjalnej stronie Szczepimysię.pl (zakładka materiały informacyjne dla szpitali) [obowiązuje od 07.06.2021].
Kwestionariusz wstępnego wywiadu przesiewowego przed szczepieniem osoby małoletniej przeciw COVID dostępny jest na oficjalnej stronie Szczepimysię.pl (zakładka materiały informacyjne dla szpitali) [obowiązuje od 07.06.2021].
Kwestionariusz wstępnego wywiadu przesiewowego przed szczepieniem dziecka w wieku 5-11 lat przeciw COVID dostępny jest na oficjalnej stronie Szczepimysię.pl (zakładka materiały informacyjne dla szpitali) [obowiązuje od 09.12.2021].
Szczepienia przeciw COVID-19 w Programie Szczepień Ochronnych
Szczepienia przeciw COVID-19 są zalecane w związku z przesłankami epidemiologicznymi wszystkim osobom od ukończenia 6 miesiąca życia, w szczególności osobom powyżej 65 roku życia oraz osobom z współistniejącymi chorobami przewlekłymi zgodnie z bieżącymi zaleceniami krajowymi oraz aktualnymi zaleceniami Europejskiej Agencji leków (EMA) i Europejskiego Centrum Kontroli Chorób (ECDC).
Czytaj więcej
Gdzie można znaleźć rzetelne informacje na temat skuteczności klinicznej szczepionek przeciw COVID-19?
Skuteczność kliniczną szczepionek przeciw COVID-19 oceniano w Europejskiej Agencji Leków w procesie dopuszczenia szczepionek do obrotu. Przeprowadzono kontrolowane randomizowane badania kliniczne (krbk) z udziałem grupy placebo.
Wyniki badań skuteczności klinicznej dostępnych na rynku szczepionek przeciw COVID-19 są wymienione są w Charakterystyce Produktu Leczniczego danego preparatu (punkt 5.1 Właściwości farmakodynamiczne).
Wyniki te zostały również opublikowane w renomowanych czasopismach naukowych:
Szczepionka mRNA Comirnaty (BioNtech/Pfizer)
95% (95% CI: 90,3-97,6) skuteczności w ochronie przed objawami COVID-19.
Polack F.P. i wsp. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. The New England Journal of Medicine, 2020, 383:2603-2615.
Szczepionka mRNA Moderna
94,1% (95% CI: 89,3-96,8) skuteczności w ochronie przed objawami COVID-19.
Baden L.R. i wsp. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine 2021, 384:403-416.
Szczepionka wektorowa Vaxzevria AstraZeneca
62% po podaniu 2 dawek (średnia ocena dla odstępu od 4 tyg. do 12 tyg.)
Voysey M. i wsp. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. The Lancet 2020, 397: P99-P111.
76% (95%CI: 59-86) po podaniu pierwszej dawki w ciągu 90 dni
54,9% (95% CI: 32,7-69,7) odstęp pomiędzy dawkami poniżej 6 tyg.
82,4% (95% CI: 62,7-91,7) odstęp pomiędzy dawkami 12 tyg.
Voysey M. i wsp. Single dose administration, and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine. The Lancet 2021, 397, P881-891.
Szczepionka wektorowa Janssenn
66,9% (95% CI: 59,0 -73,4) (ocena ≥14 dnia po szczepieniu) skuteczność w ochronie przed objawami COVID-19
76,7% (95% CI: 54,6 – 89,1) (ocena ≥14 dnia po szczepieniu) skuteczność w ochronie przed ciężkimi lub krytycznymi objawami COVID-19
100% (95% CI: 74,3-100,0) (ocena ≥28 dnia po szczepieniu) skuteczność w ochronie przed hospitalizacją z powodu COVID-19.
Sadoff J. i wsp. Safety and Efficacy of Single-Dose Ad26.COV2.S Vaccine against Covid-19. NEJM April 21, 2021.
Czy szczepionkę mRNA i wektorową przeciw COVID-19 można podawać kobietom karmiącym piersią?
W grupie kobiet karmiących piersią nie prowadzi się badań klinicznych. Stąd też w badaniach klinicznych szczepionek mRNA Comirnaty i Moderna ani szczepionki wektorowej AstraZeneca nie uczestniczyły kobiety karmiące piersią. Podobnie jak w przypadku innych dostępnych na rynku szczepionek.
Szczepionka mRNA zawiera tylko informację genetyczną o syntezie białka S wirusa SARS-CoV-2. Biorąc pod uwagę rodzaj szczepionki (szczepionka syntetyczna) oraz znany mechanizm jej działania, ryzyko niepożądanych zdarzeń u dziecka karmionego piersią przez zaszczepioną matkę jest znikome. Podobna sytuacja dotyczy również szczepionki wektorowej przeciw COVID-19 oraz innych dostępnych na rynku szczepionek. Wszystkie (poza wyjątkiem, żywa szczepionka przeciw żółtej gorączce) mogą być podawane kobiecie w okresie laktacji.
Karmienie piersią nie jest przeciwwskazaniem do podania dostępnych i stosowanych szczepionek dla dorosłych
Okres karmienia piersią nie stanowi przeciwwskazania do podania szczepionki mRNA (Comirnaty, Moderna) lub szczepionki wektorowej (AstraZeneca). W Charakterystyce Produktu Leczniczego każdej z tych szczepionek, w punkcie dotyczącym karmienia piersią wskazano jedynie, że nie wiadomo, czy szczepionka mRNA lub wektorowa przenika do mleka. Informacja ta odnosi się do tego, że w żadnym z badań klinicznych szczepionki mRNA lub wektorowej przeciw COVID-19 nie uczestniczyły kobiety okresie laktacji. Jednak biorąc pod uwagę mechanizm działania szczepionek mRNA lub szczepionki wektorowej, ryzyko niepożądanych zdarzeń u dziecka karmionego piersią jest znikome, podobnie jak w przypadku innych szczepionek dostępnych na rynku (wszystkie szczepionki, które podawane są osobom dorosłym mogą być również podawane kobietom karmiącym piersią).
Możliwe jest w tym przypadku szczególne podejście. Szczepienie może być realizowane po przedstawieniu kobiecie karmiącej informacji o szczepionce, pomimo barku danych z badań klinicznych. Dotyczy to szczególnie personelu medycznego lub innych grup ryzyka COVID-19 narażonego na zakażenie lub ciężki przebieg zakażenia SARS-CoV-2. Decyzja o szczepieniu powinna być oparta w tej grupie na ocenie korzyści i ryzyka.
Stanowiska polskich ekspertów, którzy rekomendują objęcie matek karmiących piersią szczepieniami przeciw COVID-19. Szczególnie dotyczy to kobiet z grup wysokiego ryzyka zakażenia wirusem SARS-CoV-2 – matki pracujące w ochronie zdrowia i matki wcześniaków.
Kobieta w okresie laktacji może zdecydować się na szczepienie przeciw COVID-19.
Nie zaleca się przerywania karmienia piersią w celu poddania się szczepieniu lub stosowaniu okresu karencji w karmieniu dziecka piersią po szczepieniu.
Zalecana jest indywidulana decyzja kobiety po przedstawieniu przez lekarza korzyści oraz ryzyka związanego z podaniem szczepionki przeciw COVID-19.

Czy szczepionkę przeciw COVID-19 można podawać kobiecie w ciąży i czy jest to bezpieczne?
Ciąża nie jest przeciwwskazaniem do podania szczepionki mRNA lub wektorowej przeciw COVID-19. Wprawdzie w żadnym z badań klinicznych szczepionek przeciw COVID-19 nie uczestniczyły kobiety w ciąży, jednak biorąc pod uwagę mechanizm działania tych preparatów (nie zawierają wirusów zdolnych do replikacji), ryzyko niepożądanych zdarzeń u płodu lub zaszczepionej przyszłej matki jest znikome, podobnie jak w przypadku innych szczepionek „nieżywych”/inaktywowanych. Wyniki badań nieklinicznych na zwierzętach nie wykazały zagrożenia dla płodu. W przypadku kobiety w ciąży możliwe jest szczególne podejście. Szczepienie może być przeprowadzone po przedstawieniu kobiecie w ciąży informacji o szczepionce, pomimo braku danych z badań klinicznych. Decyzja o szczepieniu przeciw COVID-19 w tej grupie powinna być oparta na ocenie korzyści i ryzyka.
Kobieta w ciąży może zdecydować się na szczepienie przeciw COVID-19 po zapoznaniu się z wiedzą na temat szczepionki.
Więcej informacji na temat zaleceń ekspertów w sprawie szczepień przeciw COVID-19 w okresie ciąży.
Czy szczepionki przeciw COVID-19 chronią przed zakażeniem wirusem SARS-CoV-2?
Dopuszczone do obrotu szczepionki przeciw COVID-19 mogą zapobiegać chorobie COVID-19 wywołanej przez wirusa SARS-CoV-2.
Europejska Agencja Leków rekomendowała warunkowe dopuszczenie do obrotu szczepionek przeciw COVID-19. Ze względu na krótki czas obserwacji wyników badań, które były oceniane w procesie dopuszczenia do obrotu, nie udało się jeszcze ocenić czy szczepionki przeciw COVID-19 chronią przed bezobjawowymi zakażeniami SARS-COV-2. Jednak badania kliniczne II/III lub III fazy (te na podstawie których szczepionki zostały warunkowo dopuszczone do obrotu) cały czas są kontynuowane (do połowy 2022 roku) i firmy zostały zobowiązane do raportowania do EMA wyników kolejnych okresów prowadzonych badań klinicznych.
Z wstępnych badań wynika, że szczepionki mają potencjał ochrony przed zakażeniem SARS-CoV-2 i zapobiegania transmisji, ale nie wiemy jeszcze w jakim zakresie. Podobnie nie wiemy jeszcze jak długo utrzymuje się ochrona poszczepienna.
Stąd też, cały czas osoby, które zostały zaszczepione w wymaganym schemacie szczepienia którąkolwiek szczepionką przeciw COVID-19 powinny przestrzegać wszystkich aktualnych wytycznych aby chronić siebie i innych: nosić maseczki, zachowywać dystans, unikać tłumów, często myć ręce, przestrzegać wskazówek dotyczących podróży, przestrzegać zaleceń dotyczących kwarantanny po kontakcie z osobą z COVID-19, przestrzegać wszelkich obowiązujących wytycznych dotyczących miejsca pracy lub szkoły.
Na czym polega warunkowe dopuszczenie do obrotu szczepionek przeciw COVID-19 w Europejskiej Agencji Leków?
Warunkowa procedura dotyczy możliwości dopuszczenia do obrotu leków i szczepionek używanych w kontekście pandemii, aby szybko reagować na zagrożenie dla zdrowia publicznego. W każdym przypadku przedstawione wyniki badań dotyczące leku lub szczepionki muszą wskazywać, że korzyści z ich stosowania przeważają nad jakimkolwiek ryzykiem.
Warunkowe pozwolenie na dopuszczenie szczepionki do obrotu oznacza bardziej szczegółowy nadzór nad bezpieczeństwem i skutecznością szczepionek w porównaniu do nadzoru prowadzonego dla innych szczepionek.
Nowe szczepionki w krajach Unii Europejskiej są dopuszczane do obrotu decyzją Komisji Europejskiej po otrzymaniu rekomendacji Europejskiej Agencji Leków (EMA). Szczepionki przeciw COVID-19 są dopuszczane w warunkowej procedurze (conditional marketing authorisation). Prowadzona jest tutaj ocena jakości, bezpieczeństwa i skuteczności szczepionki dokładnie tak, jak dzieje się to w przypadku zatwierdzania szczepionek czy leków poza pandemią. Warunkowość dotyczy aspektu dodatkowych obowiązków raportowania wynikających z wciąż prowadzonych badań klinicznych.
Szczepionki przeciw COVID-19 są warunkowo dopuszczone do obrotu na podstawie wszystkich wymaganych badań laboratoryjnych, nieklinicznych na modelu zwierzęcym, badań klinicznych I i II fazy oraz okresowej oceny prowadzonych badań klinicznych najbardziej zaawansowanej trzeciej fazy badań. Pozwolenie jest wydawane gdy korzyści wynikające z natychmiastowej dostępności szczepionki dla pacjentów przewyższają ryzyko związane z faktem, że nie wszystkie dane z trwających badań 3 fazy są jeszcze dostępne. Szczepionki zostały dopuszczone po ocenie wyników badania klinicznego 3 fazy, gdzie potwierdzono skuteczność kliniczną i bezpieczeństwo szczepionki w ochronie przed objawami COVID-19. Badania kliniczne 3 fazy są jednak cały czas kontynuowane, aby ocenić takie parametry jak np. czas utrzymywania się ochrony poszczepiennej. Przykładowo szczepionka Comirnaty została warunkowo dopuszczona do obrotu na podstawie okresowej oceny badań klinicznych 3 fazy rozpoczętych w sierpniu 2020 roku. Szczepionka została dopuszczona do obrotu, ale badania kliniczne będą zgodnie z wyjściowym planem prowadzone przez 24 miesiące.
Firma, która opracowała i produkuje szczepionkę została w ramach warunkowej procedury dopuszczenia do obrotu zobligowana do dostarczania wyników z kolejnych etapów badań klinicznych lub nowych badań w ściśle ustalonych terminach. Badania te pozwolą odpowiedzieć na pytania, na które na razie nie znamy odpowiedzi (ze względu na krótki czas prowadzenia badania klinicznego), np. jak długo utrzymuje się odporność poszczepienna, czy szczepionka chroni przed zakażeniem wirusem SAES-CoV-2.
Szczepionka dopuszczona do obrotu w trybie warunkowym jest również dodatkowo monitorowana pod kątem bezpieczeństwa w ramach badań 4 fazy. Umożliwia to szybkie zidentyfikowanie nowych sygnałów oraz informacji o jej bezpieczeństwie.
Procedura warunkowego dopuszczenia do obrotu umożliwia również szybkiej ścieżki oceny. Eksperci instytucji rejestrujących dzięki procedurze etapowej oceny dostają do oceny tak szybko jak to tylko możliwe kolejne okresowe wyniki badań, które wskazują, że korzyści z podania szczepionki przeważają ryzyko. W przypadku COVID-19 Europejska Agencja Leków wprowadziła procedury przyspieszonego przeglądu wyników badań klinicznych oraz dotyczących jakości, aby szybko przeprowadzić oceny wniosków przy jednoczesnym zapewnieniu solidnych opinii naukowych oraz wymagań dotyczycących jakości, bezpieczeństwa i skuteczności, tak samo rygorystycznych, jak w przypadku wszystkich produktów leczniczych. Utworzono specjalną grupę ds. pandemii COVID-19, która zapewnia doradztwo naukowe w zakresie badań klinicznych i opracowania produktów oraz przegląd etapowy pojawiających się dowodów wynikających z procesu wytwarzania szczepionki oraz badań klinicznych, w celu przyspieszenia oceny szczepionki, która jest w najbardziej zaawansowanym etapie badań klinicznych.
Zazwyczaj wszystkie dane dotyczące jakości, bezpieczeństwa i skuteczności szczepionki oraz wszystkie wymagane dokumenty należy przedłożyć na początku oceny w formalnym wniosku o pozwolenie na dopuszczenie do obrotu. W przypadku przeglądu etapowego (rolling review) dane są poddane ocenie i przeglądowi, jak tylko stają się dostępne w ramach trwających badań, jeszcze przed złożeniem formalnego wniosku o dopuszczenie do obrotu. Znacznie skraca to normalny czas oceny, ponieważ większość danych podlega szybkiemu przeglądowi, przy jednoczesnym zachowaniu zasad jakości, bezpieczeństwa i skuteczności.
Przykładowo cały proces oceny i rejestracji nowej szczepionki w Europejskiej Agencji Leków w normalnych warunkach trwa min. 210 dni. W przypadku przyspieszonej ścieżki w ramach warunkowej procedury dopuszczenia do obrotu może być skrócony do kilku tygodni.
COVID-19 guidance: assessment and marketing authorisation. EMA.
Jak wygląda kontrola jakości poszczególnych serii szczepionek przeciw COVID-19?
Szczepionki należą do kategorii produktów leczniczych immunologicznych i dlatego podlegają wyższym standardom bezpieczeństwa w porównaniu do innych produktów leczniczych, np. leków.
Każda seria szczepionki przed wprowadzeniem na rynek dodatkowo kontrolowana jest przez niezależne od wytwórcy laboratorium.
Szczepionki przeciw COVID-19 uzyskały warunkowe pozwolenie na dopuszczenie do obrotu (conditional marketing authorisation), gdzie ocenę naukową ich jakości, bezpieczeństwa i skuteczności prowadziła Europejska Agencja Leków. Dopuszczenie do obrotu ma formę Decyzji Komisji Europejskiej i jest wydawane na teren całej Unii Europejskiej.
Wydanie takiego pozwolenia oznacza, że UDOWODNIONO jakość, bezpieczeństwo i skuteczność kliniczną szczepionki, i że korzyść ze stosowania szczepionki przewyższa potencjalne ryzyko występowania działań niepożądanych.
KAŻDA SERIA szczepionki przed dopuszczeniem na rynek przechodzi badania jakościowe u wytwórcy oraz dodatkowo w niezależnym od wytwórcy Państwowym Laboratorium Kontroli Leków. Laboratoria z poszczególnych krajów działają w sieci OMCL- Official Medicines Control Laboratory, pod patronatem Europejskiego Dyrektoriatu ds. Jakości Leków (European Directorate for the Quality of Medicines and Healthcare, EDQM).
Rodzaj i zakres badań jakościowych wykonywanych w laboratorium sieci OMCL jest określony przez stosowne wytyczne, takie jak Europejska Administracyjna Procedura Zwalniania Serii (EU Administrative Procedure for Official Control Authority Batch Release). Na ich podstawie Laboratorium OMCL wydaje Certyfikat Zwolnienia Serii EU OCABR (EC/EEA Official Control Authority Batch Release Testing Certificate for Immunological Products), uznawany przez Państwa Członkowskie Unii Europejskiej.
Badania jakościowe danej serii szczepionki wykonane przez jedno z laboratorium sieci OMCL nie są dublowane w innych krajach.
Na polski rynek szczepionki posiadające certyfikat OCABR dopuszczane są przez Zakład Badania Surowic i Szczepionek Narodowego Instytutu Zdrowia Publicznego PZH – Państwowego Instytutu Badawczego, po weryfikacji poprawności wszystkich dokumentów i po wydaniu Orzeczenia o zwolnieniu z obowiązku kontroli seryjnej wstępnej.
Zgodnie z informacją zamieszczoną na stronie EDQM, szczepionki przeciw COVID-19 są dystrybuowane bezpośrednio do agencji rządowych i nie są przeznaczone do sprzedaży.
Gdzie można znaleźć informacje na temat liczby podanych dawek szczepionki przeciw COVID-19?
Od początku programu szczepień przeciw COVID-19 w wielu miejscach w Internecie można znaleźć interaktywne platformy, które dokumentują postępy realizacji programu szczepień przeciw COVID-19.
Aktualne informacje o liczbie zaszczepionych przeciw COVID-19 na świecie (oparte o informacje z oficjalnych źródeł w oparciu o wszystkie dostępne na świecie szczepionki) dostępne są m.in. na stronach:
- pulpit nawigacyjny Our World in Data (strona Oxford Martin School i University of Oxford).
- pulpit nawigacyjny Johns Hopkins University.
- Covid-19 Tracker. Bloomberg.
Aktualne informacje na temat realizowanego programu szczepień przeciw COVID-19 w poszczególnych krajach Unii Europejskiej dostępne są na dedykowanej platformie COVID-19 Vaccine Tracker prowadzonej przez Europejskie Centrum ds. Zapobiegania i Kontroli Chorób (ECDC). Można tam znaleźć wiarygodne dane o programach szczepień zgromadzone w ramach Europejskiego Systemu Nadzoru (TESSy). Państwa członkowskie UE / EOG zgłaszają podstawowe wskaźniki dotyczące prowadzonych programów szczepień (liczba podanych dawek szczepionek, z podziałem na konkretne produkty, pierwszą lub druga dawkę, dane dotyczące stanu zaszczepienia, wieku osób szczepionych, itp.).
Aktualne informacje na temat realizowanego programu szczepień przeciw COVID-19 w Polsce dostępne są na oficjalnej stronie Szczepimysie.
Czy należy wykonywać test serologiczny oceny poziomu przeciwciał przed lub po szczepieniu przeciw COVID-19?
Nie zaleca się wykonywania testu oceny stężenia swoistych przeciwciał przeciw SARS-CoV-2, gdyż jego wynik nie zmienia dalszego postępowania dotyczącego szczepienia.
Nie ustalono jeszcze korelatu odporności (ochronnego poziomu przeciwciał) w ochronie przed COVID-19.
Tak w przebiegu naturalnego zakażenia SARS-CoV-2 /objawów COVID-19 jak i po szczepieniu przeciw COVID-19 rozwija się humoralna odpowiedź przeciwciał oraz odpowiedź na poziomie komórkowym, która odgrywa główną rolę w ochronie przed COVID-19.
W celu sprawdzenia odpowiedzi immunologicznej przed lub po po szczepieniu przeciw COVID-19 teoretycznie należałoby wykonać oznaczenie ilościowe stężenia swoistych przeciwciał przeciw białku S (podjednostce S1 i S2 lub S1) SARS-CoV-2 w klasie IgG w surowicy (np. met. ELISA). Badań potwierdzających odporność na poziomie komórkowym nie wykonuje się rutynowo.
Nie zaleca się rutynowego badania serologicznego przed ani po szczepieniu, gdyż jego wynik nie zmienia dalszego postępowania:
- nie ustalono jakie stężenie przeciwciał i których przeciwciał koreluje z ochroną przed zachorowaniem na COVID-19,
- komercyjnie dostępne są tylko testy ELISA do pomiaru swoistych IgG wiążących białko S, testy do pomiaru neutralizacji SARS-CoV-2 wykonuje się tylko w celach naukowych,
- w przypadku zrealizowanego schematu szczepienia nie zaleca się podawania kolejnych dawek szczepionki, nawet jeśli stężenie swoistych przeciwciał IgG anty-S jest małe lub wynik badania serologicznego jest ujemny.
Szczepienie nie zwalnia z przestrzegania zaleceń sanitarnych w profilaktyce zakażeń SARS-CoV-2.
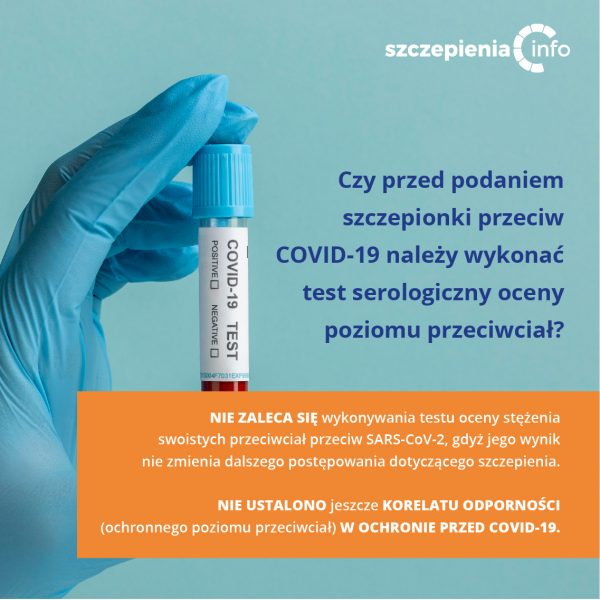
Dlaczego ozdrowieńcy powinni zaszczepić się przeciw COVID-19?
Otrzymujemy coraz więcej dowodów na to, że naturalna odporność nie jest tak skuteczna jak odpowiedź po szczepieniu. Nawet jeżeli osoba przeszła COVID-19 powinna się zaszczepić. Szczepienie może skutecznie zwiększyć i poprawić ochronę przed ponownym zachorowaniem, w tym również nowymi podwariantami Omikron SARS-CoV-2
Przebycie COVID-19 w przeszłości nie stanowi przeciwwskazania do szczepień.
Szczepienie zaktualizowaną szczepionką przeciw COVID-19 zaleca się wszystkim osobom w wieku >12 lat, niezależnie od wcześniejszego przebycia zakażenia SARS-CoV-2 (objawowego lub bezobjawowego), również osobom z przedłużającymi się objawami COVID-19.
U osób aktualnie zakażonych SARS-CoV-2 szczepienie należy opóźnić przynajmniej do momentu ustąpienia ostrych objawów choroby (jeżeli przebieg jest objawowy) i zakończenia izolacji.
U ozdrowieńców można rozważyć odroczenie szczepienia o 3 miesiące od wystąpienia objawów COVID-19 lub otrzymania dodatniego wyniku badania w kierunku zakażenia SARS-CoV-2.
Badania wykazały, że wydłużenie czasu pomiędzy zakażeniem a szczepieniem może skutkować poprawą odpowiedzi immunologicznej na szczepienie Zaobserwowano także niskie ryzyko ponownego zakażenia w ciągu tygodni lub miesięcy po zakażeniu. Przy podejmowaniu decyzji, czy opóźniać zaszczepienie się przeciw COVID-19 po zakażeniu, należy wziąć pod uwagę indywidualne czynniki, takie jak ryzyko wystąpienia ciężkiej choroby COVID-19 lub charakterystyka dominującego szczepu SARS-CoV-2.
Odporność naturalna w przebiegu zakażenia różni się znacznie w zależności od osoby, a przy braku poziomu ochronnego przeciwciał, nie możemy być pewni, czy przebycie choroby z określonym uodpornieniem na poziomie przeciwciał jest wystarczające dla osób starszych z grup ryzyka lub tych, którzy mieli bardzo łagodny COVID-19.
Reinfekcje są możliwe. Ponowne zachorowania na COVID-19 w pierwszych miesiącach po zakażeniu SARS-CoV-2 zdarzają się rzadko. Szacuje się, że dotyczą < 1% wszystkich przypadków zachorowań. Jednak ze względu na poważne zagrożenie dla zdrowia związane z COVID-19 i fakt, że możliwe jest ponowne zachorowanie na COVID-19 w okresie późniejszym, należy zalecać szczepienie przeciw COVID-19, również u ozdrowieńców.
Z danych CDC wynika, że szczepienie ozdrowieńców zmniejsza liczbę reinfekcji. Wykazano, że ozdrowieńcy niezaszczepieni byli o 2,34 razy bardziej narażeni na ryzyko reinfekcji w porównaniu do zaszczepionych bez kontaktu z wirusem. Badanie pokazuje, że szczepienie ozdrowieńców zdecydowanie zmniejsza ryzyko reinfekcji, co ma szczególne znaczenie przy wariantach budzących obawy.
Cały czas prowadzone są badania czasu utrzymywania się odporności po COVID-19 oraz czasu po jakim dochodzi do reinfekcji w populacji.
Osoby, które chorowały na COVID-19, powinny zostać zaszczepione, aby uchronić się przed ponownym zachorowaniem.
Czy szczepionki przeciw COVID-19 zawierają materiał pochodzący od człowieka?
W składzie żadnej z dostępnych w Polsce szczepionek nie ma materiału pochodzącego od człowieka (nie ma tam komórek ani fragmentów ludzkiego DNA).
W procesie wytwarzania niektórych szczepionek wirusowych mogą być wykorzystywane linie komórkowe pochodzące z materiału ludzkiego. Wynika to stąd, że niektóre wirusy wchodzące w skład szczepionek są hodowane w warunkach laboratoryjnych, w specjalnych liniach komórkowych, które wyjściowo w latach 60-80 tych XX wieku zostały wyprowadzone z materiału pochodzącego z ludzkich komórek zarodkowych pobranych w wyniku zabiegu sztucznego poronienia. Aborcje przeprowadzono z przyczyn pozamedycznych, po wyroku sądu. Żadnej z tych aborcji nie wykonano w celu pobrania komórek zarodka do otrzymania linii komórkowych. Te same linie komórek uzyskane z komórek zarodka w przeszłości są przechowywane i namnażane do dziś, a dzięki nim możliwe jest nie tylko stosowanie szczepionek, ale również wiele innych, zaawansowanych leków.
Wśród dostępnych na rynku szczepionek przeciw COVID-19 sytuacja wygląda następująco:
- Szczepionka Comirnaty Pfizer i BioNTech jest szczepionką mRNA. W procesie jej wytwarzania nie wykorzystuje się wirusa SARS-CoV-2 ani innych wirusów, nie ma więc potrzeby ich hodowli, stąd też nie wykorzystuje się linii komórkowych pochodzących z materiału ludzkiego.
- Szczepionka Moderna jest szczepionką mRNA. W procesie jej wytwarzania nie wykorzystuje się wirusa SARS-CoV-2 ani innych wirusów, nie ma więc potrzeby ich hodowli, stąd też nie wykorzystuje się linii komórkowych pochodzących z materiału ludzkiego.
- Szczepionka Vaxzevria (AstraZeneca) jest szczepionką, która zawiera niereplikujący się wektor wirusowy. W procesie jej wytwarzania adenowirus szympansi jako wektor jest przygotowywany w linii komórek HEK293 uzyskanej z ludzkich embrionalnych komórek nerki uzyskanych w wyniku aborcji przeprowadzonej w 1972 roku.
- Szczepionka Janssen jest szczepionką, która zawiera niereplikujący się wektor wirusowy. W procesie jej wytwarzania adenowirus ludzki typu 26 jako wektor jest przygotowywany w linii komórek PER.C6 uzyskanej z komórek siatkówki zarodka ludzkiego uzyskanych w wyniku aborcji przeprowadzonej w 1985 roku.
W Polsce aktualnie dostępne są również szczepionki stosowane w Programie Szczepień Ochronnych, w których procesie wytwarzania stosuje się dwie linie komórkowe pochodzące z ludzkich komórek zarodkowych:
- linia WI-38, która służy do namnażania wirusa różyczki (szczep RA 27/3), wchodzącego w skład szczepionek MMR przeciw odrze, śwince i różyczce. Linia WI-38 jest linią diploidalnych komórek zarodka ludzkiego uzyskaną z materiału pobranego w wyniku zabiegu sztucznego poronienia, który decyzją amerykańskiego sądu przeprowadzono w 1964 roku;
- linia MRC-5, która służy do namnażania szczepionkowego wirusa zapalenia wątroby typu A oraz szczepionkowego wirusa ospy wietrznej. Linia MRC-5 jest linią diploidalnych komórek zarodka ludzkiego, którą również uzyskano z materiału pobranego w wyniku zabiegu sztucznego poronienia przeprowadzonego w 1966 roku.
Linie komórkowe, takie jak WI-38 czy MRC-5, stosuje się również w procesie wytwarzania dostępnych na rynku leków przeciwko licznym chorobom, takim jak hemofilia, reumatoidalne zapalenie stawów, czy mukowiscydoza.
Żadna z dostępnych na rynku szczepionek wirusowych, a także żadna z opracowywanych szczepionek przeciw COVID-19 nie zawiera materiału pochodzącego od człowieka.
Do której grupy należą szczepionki przeciw COVID-19, „żywych” czy „zabitych”?
Lekarze stosują podział szczepionek na dwie grupy:
- ZABITE (inaktywowane, nieżywe), np. DTP (szczepionka przeciw błonicy, tężcowi i krztuścowi), IPV (inaktywowana szczepionka przeciw polio), szczepionka przeciw grypie (we wstrzyknięciu), szczepionka przeciw pneumokokom, szczepionka przeciw meningokokom,
- ŻYWE (atenuowane z osłabionym wirusem lub bakterią), np. MMR (szczepionka przeciw odrze, śwince i różyczce), szczepionka przeciw ospie wietrznej, szczepionka przeciw rotawirusom, szczepionka BCG przeciw gruźlicy, szczepionka przeciw grypie (donosowa).
Podział ten ma swoje odbicie w procesie kwalifikacji do szczepienia. Warunkuje wymagane odstępy pomiędzy poszczególnymi szczepionkami oraz przeciwwskazania do ich podania w określonych grupach pacjentów. Np. podanie dwóch szczepionek żywych na różnych wizytach szczepiennych wymaga zachowania odstępu co najmniej 4 tygodni. Z kolei szczepionki żywe nie powinny być podawane w określonych grupach pacjentów, np. z zaburzeniami układu odporności.
Szczepionki przeciw COVID-19, tak mRNA [Comirnaty (Pfizer) i Moderna] jak i wektorowe [Vaxzevria (AstraZeneca) i Janssen] traktujemy w procesie kwalifikacji do szczepienia tak samo jak szczepionki z grupy szczepionek „zabitych/nieżywych”.
Szczepionki przeciw COVID-19 nie zawierają ŻADNYCH wirusów zdolnych do replikacji (podziału):
- szczepionki mRNA zawierają fragment mRNA wirusa SARS-CoV-2 kodujący białko S kolca,
- szczepionki wektorowe zawierają defektywny, niezdolny do replikacji (podziału) adenowirus (wektor) z wbudowanym fragmentem materiału genetycznego wirusa SARS-CoV-2 kodującym białko S kolca.
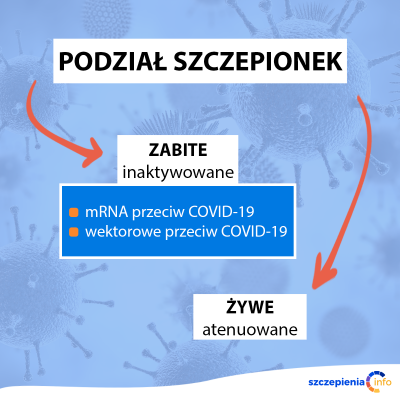
Co oznacza termin „w pełni zaszczepiony” przeciw COVID-19?
Termin „w pełni zaszczepiony” przeciw COVID-19 odnosi się do osób, które zakończyły podstawowy schemat szczepienia (najczęściej to 2 dawki szczepionki).
Termin „aktualnie zaszczepiony” przeciw COVID-19 odnosi się do osób, które otrzymały wszystkie dawki szczepionki (schemat podstawowy oraz zalecane dawki przypominające) zalecane dla wieku i stanu zdrowia.
Jak wygląda rejestracja na szczepienie przeciw COVID-19 obcokrajowca?
- Cudzoziemcy z prawem pobytu podlegają szczepieniom przeciw COVID-19 na takich samych zasadach jak obywatele polscy.
- Osoby, które mają prawo pobytu w Polsce powinni zgłosić się do swojego lekarza rodzinnego w celu wystawienia e-skierowania na szczepienie.
- Lekarz POZ powinien wystawić skierowanie na szczepienie za pośrednictwem aplikacji gov.pl. W trakcie wystawiania skierowania w polu dane pacjenta lekarz powinien wybrać „Inny identyfikator” (zamiast „Numer PESEL”) i wprowadzić numer dokumentu tożsamości, jakim posługuje się obcokrajowiec (numer paszportu lub zagranicznego dowodu osobistego). Wskazany w e-skierowaniu dokument obcokrajowiec powinien zabrać ze sobą na szczepienie w celu identyfikacji pacjenta i wypełnienia karty szczepień.
- Na podstawie wystawionego w systemie e-skierowania obcokrajowiec może zarejestrować się na szczepienie za pośrednictwem przeznaczonej do tego infolinii pod numerem 989, wysyłając SMS o treści SzczepimySie na numer 664 908 556 lub bezpośrednio w wybranym punkcie szczepień.
- Na każdym etapie procesu realizacji szczepienia obcokrajowiec powinien posługiwać się dokładnie tym samym dokumentem tożsamości, który posłużył do wystawienia e-skierowania.
- Szczepienia przeciw COVID-19 dla obcokrajowców przebywających w Polsce są bezpłatne.
Źródło: Szczepienie przeciwko COVID-19 obcokrajowców przebywających w Polsce. Medycyna Praktyczna/Szczepienia.
Jak zgłosić szczepienie p/COVID-19 wykonane zagranicą?
Osoba zaszczepiona przeciw COVID-19 zagranicą, która chce otrzymać dawkę przypominającą w Polsce oraz Unijny Certyfikat COVID-19 (UCC) powinna zgłosić się do punktu szczepień wraz z wymaganymi dokumentami.
Szczepienia przeciw COVID-19 przyjęte poza granicami Polski można zarejestrować w wybranym punkcie szczepień.
Osoba zaszczepiona zagranicą, która nie ma jeszcze wydanego certyfikatu UCC powinna przedstawić w punkcie szczepień wymagane dokumenty:
- Oryginał i kopię dokumentu (zaświadczenia) potwierdzającego przyjęcie szczepienia przeciwko COVID-19 poza granicami kraju, zgodnego z wzorem obowiązującym w państwie przyjęcia szczepienia.
- Tłumaczenie przysięgłe dokumentu, o którym mowa w pkt 1.
- Podpisać zgodę na przetwarzanie danych osobowych.
Dostarczone dokumenty (za wyjątkiem oryginału zaświadczenia) włącza się do dokumentacji medycznej pacjenta przechowywanej w punkcie szczepień.
Osoba, która posiada certyfikat UCC wydany w innym kraju, może poprosić o wprowadzenie danych o szczepieniu do krajowego systemu ewidencji szczepień w Polsce.
W tym celu należy zgłosić się do wybranego punktu szczepień i przedstawić:
- Oryginał i kopię UCC, potwierdzającego przyjęcie szczepienia przeciwko COVID-19 poza granicami kraju. Nie wymaga się, aby certyfikat UCC był tłumaczony na język polski.
- Podpisać zgodę na przetwarzanie danych osobowych.
Kopię UCC włącza się do dokumentacji medycznej pacjenta przechowywanej w punkcie szczepień.
Niezbędne jest przedstawienie UCC potwierdzającego przyjęcie każdej z dawek szczepionki p/COVID-19.
Szczegóły w komunikacie Ministra Zdrowia oraz na oficjalnej stronie poświęconej szczepieniom p/COVID-19.
Jak można uzyskać Unijny Certyfikat COVID-19 (UCC)?
Unijny Certyfikat COVID-19 (UCC) zostanie wygenerowany automatycznie po wprowadzeniu danych o szczepieniu przeciw COVID-19 do krajowego systemu ewidencji szczepień w Polsce.
Unijny Certyfikat COVID-19 (UCC) można:
- samodzielnie pobrać i wydrukować z Internetowego Konta Pacjenta
- pobrać z aplikacji mobilnej „mObywatel”,
- poprosić o wydrukowanie UCC podczas wizyty w wybranym punkcie szczepień p/COVID-19 lub w placówce POZ.
Szczegóły w komunikacie Ministra Zdrowia.
Jaka jest ważność certyfikatu szczepionkowego?
W Polsce Unijny Certyfikat Covidowy (UCC) od 26.04.2022 r. jest ważny bezterminowo dla osób dorosłych, które przyjęły trzecią, przypominającą dawkę szczepionki przeciw COVID-19.
UCC dla dzieci do 18 roku życia jest bezterminowy w całej UE.
Rada i Parlament Europejski przedłużyły ważność unijnego certyfikatu COVId-19 do 30 czerwca 2023 roku. Podróżni mogą nadal używać swoich certyfikatów przy wjeździe do krajów UE, które ich wymagają. Państwa członkowskie nie są jednak zobowiązane do stosowania certyfikatów.
Jak zgłosić szczepienie p/COVID-19 wykonane zagranicą, aby otrzymać dawkę przypominającą w Polsce?
Po wprowadzeniu danych dotyczących szczepienia p/COVID-19 do krajowego systemu ewidencji szczepień, dawkę przypominającą szczepienia p/COVID-19 można przyjąć także w Polsce.
Uznanie szczepienia podstawowego przeciw COVID-19, wykonanego poza granicami UE, możliwe jest wyłącznie w przypadku szczepionek dopuszczonych do obrotu na terytorium Unii Europejskiej (UE) lub równoważnych tym szczepionkom, które zostały ujęte w wykazie odpowiedników szczepionek dopuszczonych do obrotu na terytorium RP.
Uznanie szczepienia przypominającego wykonanego za granicą możliwe jest wyłącznie w przypadku szczepionek stosowanych jako dawka przypominająca w Polsce.
Szczegóły w komunikacie Ministra Zdrowia oraz na oficjalnej stronie poświęconej szczepieniom p/COVID-19.
-
 Jak działa szczepionka mRNA?
Jak działa szczepionka mRNA?
-
 Jak działa szczepionka wektorowa?
Jak działa szczepionka wektorowa?
-
 Kiedy pojawia się odporność po szczepieniu?
Kiedy pojawia się odporność po szczepieniu?
-
 NOP po szczepionkach przeciw COVID-19
NOP po szczepionkach przeciw COVID-19
-
 Skład szczepionki mRNA przeciw COVID-19
Skład szczepionki mRNA przeciw COVID-19
-
 Skład szczepionki mRNA przeciw COVID-19
Skład szczepionki mRNA przeciw COVID-19
-
 Skład szczepionki wektorowej przeciw COVID-19
Skład szczepionki wektorowej przeciw COVID-19
-
 Szczepienia przeciw COVID-19 nastolatków
Szczepienia przeciw COVID-19 nastolatków
-
 Szczepionki ratują życie
Szczepionki ratują życie
-
 Bezpieczna szczepionka 1
Bezpieczna szczepionka 1
-
 Bezpieczna szczepionka 2
Bezpieczna szczepionka 2
-
 Podział szczepionek przeciw COVID-19
Podział szczepionek przeciw COVID-19
-
 Szczepionki przeciw COVID-19 są bezpieczne
Szczepionki przeciw COVID-19 są bezpieczne
-
 Bezpieczeństwo szczepionek przeciw COVID-19
Bezpieczeństwo szczepionek przeciw COVID-19
-
 Szczepienia dzieci i młodzieży
Szczepienia dzieci i młodzieży
-
 Covid-19 (ściąga) (pdf)
Covid-19 (ściąga) (pdf)
-
 Covid-19 (ściąga) (jpg)
Covid-19 (ściąga) (jpg)
- Transmission of SARS-CoV-2: implications for infection prevention precautions. (podsumowanie danych naukowych z 9 lipca 2020).
- Harrison AG, Lin T, Wang P. Mechanisms of SARS-CoV-2 Transmission and Pathogenesis. Trends Immunol. 2020 Dec;41(12):1100-1115.