
Szczepienia przeciw COVID-19
Podsumowanie
Jakie rodzaje szczepionek przeciw COVID-19 są opracowywane?
Wśród opracowywanych rodzajów szczepionek przeciw COVID-19 stosowane są technologie dobrze znane i od lat stosowane na rynku, jak szczepionki podjednostkowe z adiuwantami, preparaty zawierające osłabionego wirusa, szczepionki z cząstkami wirusopodobnymi oraz innowacyjne technologie, wcześniej niestosowane jeszcze u ludzi na szerszą skalę lub stosowane w ograniczonym zakresie, tj. szczepionki zawierające mRNA koronawirusa SARS-CoV-2 oraz szczepionki wektorowe.
Najbardziej zaawansowane prace dotyczą 3 rodzajów preparatów szczepionkowych:
- szczepionek mRNA
- szczepionek wektorowych
- szczepionek podjednostkowych
Szczepionki mRNA zawierają informacyjny kwas rybonukleinow (mRNA) kodujący białko S (kolca) wirusa SARS-CoV-2. Kwas ten zamknięty jest w kapsułce z nanocząsteczek lipidowych. Kapsułka pełni funkcję ochronną zabezpieczając mRNA przed degradacją oraz funkcję transportową pomagając mu dostać się do komórki. Na podstawie informacji z mRNA w komórce gospodarza syntetyzowane jest białko S (kolca) SARS-CoV-2, które będąc silnym antygenem pobudza odpowiedź odpornościową w postaci przeciwciał neutralizujących (odpowiedź humoralna) i stymuluje wytwarzanie limfocytów T (odpowiedź komórkowa).
Zaawansowane badania dotyczą:
- szczepionki mRNA firm Pfizer i BioNTech,
- szczepionki mRNA firmy Moderna
- szczepionki mRNA firmy CurVac.
Szczepionki wektorowe składają się z niezdolnego do replikacji wirusa (np. adenowirusa zwierzęcego), do którego wbudowany jest gen kodujący informację genetyczną o syntezie białka S (kolca) SARS-CoV-2. Dzięki temu syntetyzowane jest białko S, które jako antygen pobudza odpowiedź odpornościową w postaci przeciwciał neutralizujących i odpowiedź komórkową. Adenowirus w szczepionce pełni funkcję wektora, który jest małą fabryką, która „produkuje” antygen szczepionkowy. Wektor jest bezpieczny, został tak dobrany, że nie namnaża się w organizmie człowieka, nie wykazuje również właściwości zakaźnych.
Zaawansowane badania dotyczą:
- szczepionki wektorowej firmy Astra Zeneca we współpracy z Uniwersytetem Oksfordzkim,
- szczepionki wektorowej firmy Johnson&Johnson,
- szczepionki wektorowej Sputnik V.
Szczepionki białkowe rekombinowane zawierają oczyszczone białko S (kolca) SARS-CoV-2 lub fragment białka. W celu wzbudzenia silnej odpowiedzi odpornościowej do szczepionki dodawany jest często adiuwant.
Zaawansowane badania dotyczą:
- szczepionki rekombinowanej z adiuwantem firmy Novavax,
- szczepionki rekombinowanej z adiuwantem firmy Sanofi-GSK.
Gdzie znaleźć ulotkę i Charakterystykę Produktu Leczniczego szczepionki mRNA przeciw COVID-19 dostępnej w Wielkiej Brytanii i Stanach Zjednoczonych?
Wielka Brytania
2 grudnia 2020 roku brytyjska agencja rejestrująca Medicines and Healthcare Products Regulatory Agency (MHRA) dopuściła na rynek w procedurze „temporary supply” pierwszą szczepionkę mRNA przeciw COVID-19, tj. szczepionkę BNT162b2 firm Pfizer i BioNTech.
Zalecenia dotyczące szczepień opracowuje tam Komitet ds. Szczepionek i Szczepień (Joint Committee on Vaccinations and Immunisations (JCVI).
Szczepionka BNT162b2 firm Pfizer i BioNTech dostępna w Wielkiej Brytanii
Charakterystyka Produktu Leczniczego dla lekarza
Więcej informacji o szczepionce BNT162b2 firm Pfizer i BioNTech dostępna jest na stronie gov.uk.
Stany Zjednoczone
11 grudnia 2020 roku amerykański Urząd ds. Żywności i Leków (Food and Drug Administration – FDA) wydał pozwolenie na użycie w sytuacji wyjątkowej (emergency use authorization, EUA) szczepionki mRNA przeciw COVID-19 o nazwie BNT162b2 firm Pfizer i BioNTech.
Zalecenia dotyczące stosowania tej szczepionki opracował Komitet ds. Szczepień ( Advisory Committee on Immunization Practices, ACIP). Zalecenia mają charakter tymczasowy i będą aktualizowane w miarę pojawiania się dodatkowych danych.
Szczepionka BNT162b2 firm Pfizer i BioNTech dostępna w Stanach Zjednoczonych
Charakterystyka Produktu Leczniczego dla lekarza (29 stron)
Decyzja FDA o dopuszczeniu do obrotu szczepionki BNT162b2 firm Pfizer i BioNTech
Strona FDA poświęcona szczepionkom przeciw COVID-19.
Gdzie znaleźć informacje na temat szczepionki mRNA firmy Moderna?
18 grudnia br. amerykański Urząd ds. Żywności i Leków (Food and Drug Administration, FDA) podjął decyzję o dopuszczeniu do obrotu w sytuacji wyjątkowej (emergency use authorization, EUA) szczepionki mRNA-1273 firmy Moderna. Szczepionka może być stosowana w programie szczepień w ochronie przed COVID-19 u osób w wieku 18 lat i starszych.
Badania bezpieczeństwa i skuteczności klinicznej szczepionki mRNA-1273 pochodzą z badania trzeciej fazy z randomizacją przeprowadzonego metodą podwójnie ślepej próby i placebo w grupie kontrolnej. W badaniu wzięło udział 30 420 uczestników w wieku 18–95 lat, z czego 25% stanowiły osoby w wieku ≥65 lat lub 18–65 lat z chorobami towarzyszącymi. Szczepionkę podawano domięśniowo w odstępie 28 dni. W czasie obserwacji w grupie badanej wystąpiło 11 przypadków COVID-19, w grupie kontrolnej, gdzie podawano placebo – 185 przypadków zachorowań. Wyniki te pozwoliły ocenić skuteczność szczepionki w ochronie przed COVID-19 na poziomie 94,1%. Zachorowania z ciężkim przebiegiem COVID-19 wystąpiły jedynie w grupie kontrolnej. Dotychczasowe wyniki badań klinicznych nie pozwalają ocenić jak długo będzie utrzymywała się ochrona po szczepieniu. Nie ma również dowodów na czy szczepionka zapobiega transmisji SARS-CoV-2 z człowieka na człowieka.
Najczęściej zgłaszanymi niepożądanymi odczynami poszczepiennymi, utrzymującymi się zwykle kilka dni, były: ból w miejscu wstrzyknięcia, zmęczenie, ból głowy, ból mięśni, dreszcze, ból stawów, powiększenie węzłów chłonnych, nudności i wymioty oraz gorączka. Ogółem zdarzenia niepożądane rzadziej obserwowano u starszych uczestników badania. Działania niepożądane występowały częściej po podaniu drugiej dawki szczepionki. Obserwację występowania działań niepożądanych w ramach ww badania klinicznego prowadzono do 2 miesięcy po podaniu drugiej dawki szczepionki. W badaniu klinicznym odnotowano 3 przypadki porażenia typu Bella, które wystąpiły w grupie badanej oraz 1 przypadek w grupie kontrolnej. Obecnie nie ma podstaw, aby stwierdzić związek przyczynowy między szczepieniem a wystąpieniem porażenia typu Bella. FDA rekomenduje jednak wzmożony nadzór w tym obszarze. W ocenianym badaniu klinicznym nie wystąpił żaden przypadek ciężkiej reakcji alergicznej.
Więcej informacji na temat szczepionki mRNA firmy Moderna można znaleźć w Charakterystyce Produktu Leczniczego.
Badanie kliniczne 3 fazy, gdzie oceniana jest skuteczność i bezpieczeństwo szczepionki będzie kontynuowane do października 2022 roku.
Szczepionka mRNA-1273 to drugi już preparat szczepionkowy przeciw COVID-19, który uzyskał pozytywną ocenę FDA i będzie stosowany w masowym programie szczepień przeciw COVID-19 w Stanach Zjednoczonych. Szczepionka mRNA firmy Moderna zawiera mały fragment informacyjnego RNA (mRNA), czyli informację o tym jak wytworzyć antygen szczepionkowy. Po podaniu szczepionki nasz organizm wytwarza białko S koronawirusa SARS-CoV-2, które nie powoduje choroby, ale będąc antygenem uruchamia układ odpornościowy, aby nauczyć go jak wytworzyć odpowiedź immunologiczną przeciw SARS-CoV-2.
Szczepionkę opracowała amerykańska firma Moderna we współpracy z National Institute of Allergy and Infectious Diseases (NIAID).
Preparat można przechowywać w temperaturze 2–8°C, zachowuje swoje właściwości do 30 dni w lodówce i do 12 godzin w temperaturze pokojowej.
Ile czasu potrzebujemy na opracowanie nowej szczepionki przeciw COVID-19?
Czas wymagany do opracowania nowej szczepionki przeciw COVID-19 jest trudny do przewidzenia. Szczepionka jako produkt leczniczy musi przejść określone fazy badań przedklinicznych i klinicznych, a następnie zostać zarejestrowana w procesie kontroli zwanym dopuszczeniem do obrotu.
Proces opracowania nowej szczepionki zależy od wielu czynników, ale trwa średnio ok. 10 a nawet więcej lat.
Składają się na niego:
- badania laboratoryjne
- testy przedkliniczne na modelach zwierzęcych (śr. 1-1,5 lat)
- I faza badań klinicznych (śr. 1-2 lata)
- II faza badań klinicznych (2 lata lub więcej)
- III faza badań klinicznych (śr. 3-4 lata)
- przygotowywanie infrastruktury do produkcji szczepionki (fabryki, linie produkcyjne) (śr. 3 lata)
- proces dopuszczenia do obrotu (rejestracja) (min. 210 dni)
W przypadku szczepionki pandemicznej przeciw COVID-19 czas jej opracowania jest skrócony. W normalnych warunkach kolejne etapy badań przedklinicznych i klinicznych następują po sobie. W procesie opracowania szczepionki przeciw COVID-19 cały proces może być przyspieszony, ponieważ wiele etapów badań prowadzonych jest równolegle lub się zazębia. Zainwestowano ogromne środki finansowe w prace dotyczące opracowania szczepionek przeciw COVID-19. W przypadku najbardziej obiecujących potencjalnych preparatów szczepionkowych przygotowywana jest infrastruktura wymagana do ich produkcji na wielką skalę (fabryki, linie produkcyjne dostosowane do produkcji szczepionki). Dzięki temu w przypadku dopuszczenia szczepionki do obrotu, dana szczepionka będzie mogła być udostępniona szybciej.
Podobnie możliwy jest szybszy proces formalnej oceny samej szczepionki, tzw. dopuszczenia nowego produktu leczniczego do obrotu. Instytucją odpowiedzialną za ten proces w Unii Europejskiej jest Europejska Agencja Leków (EMA). Na podstawie oceny sytuacji związanej z postępem prac dotyczących opracowywanych szczepionek EMA szacuje, że nowa szczepionka przeciw COVID-19 może być gotowa do wprowadzenia na rynek nie wcześniej niż na początku 2021 rok.
EMA może w procesie dopuszczenia do obrotu nowej szczepionki przeciw COVID-19 wykorzystać tzw. szybką ścieżkę oceny. Taka procedura możliwa jest w sytuacji oceny produktów ważnych w walce z zagrożeniami zdrowia publicznego. W takiej sytuacji prowadzona jest procedura etapowa, która wyjątkowo pozwala na rozpoczęcie oceny przez ekspertów EMA, jeszcze podczas prowadzonych badań klinicznych. Dzięki temu, kiedy opracowanie nowego produktu jest na tyle zaawansowane, że firma składa wniosek o wydanie pozwolenia na dopuszczenie do obrotu, formalna procedura oceny jakości, bezpieczeństwa i skuteczności szczepionki może odbyć się już w stosunkowo krótkim czasie, ponieważ oceniający eksperci prowadzili ocenę na wcześniejszych etapach. Poszczególne cykle oceny trwają około 2 tygodni, w zależności od obszerności przedstawianej dokumentacji z wynikami badań. Takie działania pozwalają na maksymalne skrócenie procesu oceny w porównaniu do procesu, który w normalnych warunkach trwa min. 210 dni.
Europejska Agencja Leków szacuje, że nowa szczepionka przeciw COVID-19 może być gotowa do wprowadzenia na rynek nie wcześniej niż na początku 2021 rok.
Dlaczego szczepionki przeciw COVID-19 udało się tak szybko opracować?
Przy opracowaniu szczepionek przeciw COVID-19 zastosowano przyspieszony harmonogram poszczególnych etapów badań narzucony przez wyzwania związane z pandemią SARS-CoV-2. Pandemia jest sytuacją nadzwyczajną. Aby usprawnić opracowanie szczepionek przeciw COVID-19 wprowadzono możliwości szybszego przeprowadzenia poszczególnych etapów badań. W normalnych warunkach kolejne etapy badań przedklinicznych i klinicznych następują po sobie. W procesie opracowania szczepionki przeciw COVID-19 cały proces mógł być przyspieszony, ponieważ wiele etapów badań prowadzono równolegle lub się zazębiały. Każda szczepionka była sprawdzana w laboratorium, w badaniach nieklinicznych na zwierzętach oraz w trzech etapach badań klinicznych na ludziach. Żadnego z tych etapów nie pominięto. Badania kliniczne trzeciej fazy prowadzone są w dużych grupach.
Zainwestowano ogromne środki finansowe w prace dotyczące najbardziej obiecujących potencjalnych preparatów szczepionkowych. Dotyczyło to szczególnie wcześniejszego przygotowania infrastruktury wymaganej do produkcji szczepionek na wielką skalę (fabryki, linie produkcyjne dostosowane do produkcji szczepionki). Dzięki temu możliwa była produkcja szczepionki, jeszcze w czasie trwania badań klinicznych, przed dopuszczeniem szczepionki do obrotu. Dzięki temu szczepionka dopuszczona do obrotu przez urząd rejestrujący jest od razu przygotowana do dystrybucji.
Podobnie umożliwiono szybszy proces naukowej oceny szczepionki, tzw. dopuszczenia nowego produktu leczniczego do obrotu. Instytucją odpowiedzialną za ten proces w Unii Europejskiej jest Europejska Agencja Leków (EMA).
EMA zastosowała w procesie dopuszczenia do obrotu nowych szczepionek przeciw COVID-19 tzw. szybką ścieżkę oceny. Taka procedura możliwa jest w sytuacji oceny produktów ważnych w walce z zagrożeniami zdrowia publicznego. W takiej sytuacji prowadzona jest procedura etapowa, która wyjątkowo pozwala na rozpoczęcie oceny przez ekspertów EMA, jeszcze podczas prowadzonych badań klinicznych. Dzięki temu, kiedy opracowanie nowego produktu jest na tyle zaawansowane, że firma składa wniosek o wydanie pozwolenia na dopuszczenie do obrotu, procedura oceny jakości, bezpieczeństwa i skuteczności szczepionki może odbyć się już w stosunkowo krótkim czasie, ponieważ eksperci prowadzili ocenę na wcześniejszych etapach. Takie działania pozwalają na maksymalne skrócenie procesu oceny w porównaniu do procesu, który w normalnych warunkach trwa min. 210 dni.
Jak wygląda przyspieszony proces rejestracji szczepionek przeciw COVID-19 w Europie?
Szczepionki przeciw COVID-19 jako nowe produkty lecznicze na rynku, przed ich wprowadzeniem na rynek muszą zostać dopuszczone do obrotu przez Europejską Agencję Leków.
W przypadku COVID-19 Europejska Agencja Leków wprowadziła procedury przyspieszonego przeglądu wyników badań klinicznych oraz dotyczących jakości, aby szybko przeprowadzić oceny wniosków przy jednoczesnym zapewnieniu solidnych opinii naukowych oraz wymagań dotyczycących jakości, bezpieczeństwa i skuteczności, tak samo rygorystycznych, jak w przypadku wszystkich produktów leczniczych. Utworzono specjalną grupę ds. pandemii COVID-19, która zapewnia doradztwo naukowe w zakresie badań klinicznych i opracowania produktów oraz przegląd etapowy pojawiających się dowodów wynikających z procesu wytwarzania szczepionki oraz badań klinicznych, w celu przyspieszenia oceny szczepionki, która jest w najbardziej zaawansowanym etapie badań klinicznych.
Zazwyczaj wszystkie dane dotyczące jakości, bezpieczeństwa i skuteczności szczepionki oraz wszystkie wymagane dokumenty należy przedłożyć na początku oceny w formalnym wniosku o pozwolenie na dopuszczenie do obrotu. W przypadku przeglądu etapowego dane są poddane ocenie i przeglądowi, jak tylko stają się dostępne w ramach trwających badań, jeszcze przed złożeniem formalnego wniosku. Znacznie skraca to normalny czas oceny, ponieważ większość danych podlega szybkiemu przeglądowi, przy jednoczesnym zachowaniu zasad jakości, bezpieczeństwa i skuteczności. Zazwyczaj po skompletowaniu pakietu danych producent składa formalny wniosek o pozwolenie na dopuszczenie do obrotu.
Przykładowo cały proces oceny i rejestracji nowej szczepionki w Europejskiej Agencji Leków w normalnych warunkach trwa min. 210 dni. W przypadku przyspieszonej ścieżki może być skrócony do kilku tygodni.
Dotychczas Europejska Agencja Leków rozpoczęła wstępną etapową procedurę oceny 3 szczepionek przeciw COVID-19:
Procedura etapowej oceny szczepionek przeciw COVID-19 umożliwia przyspieszenie każdego etapu w procesie dopuszczenia produktu leczniczego do obrotu, przy jednoczesnym zapewnieniu rzetelnych dowodów naukowych dotyczących skuteczności, bezpieczeństwa i jakości.
Wymogi bezpieczeństwa dotyczące szczepionek przeciw COVID-19 są tak samo rygorystyczne jak w przypadku innych szczepionek dostępnych w Europie i pandemia tego nie zmieni.
Innowacyjność zastosowania mRNA w szczepionkach przeciw COVID-19
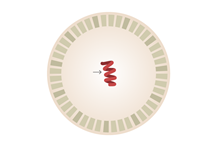 Szczepionki mRNA przeciw COVID-19 składają się z informacyjnego kwasu rybonukleinowego mRNA kodującej białko S (kolca) wirusa SARS-CoV-2 zamkniętego w kapsułce z nanocząsteczek lipidowych. Kapsułka pełni funkcję ochronną oraz funkcję transportową pomagając przeniknąć do komórki pokonując barierę błony komórkowej. Na podstawie mRNA w komórce gospodarza syntetyzowane jest białko S (kolca) SARS-CoV-2, które będąc silnym antygenem pobudza odpowiedź odpornościową w postaci przeciwciał neutralizujących (odpowiedź humoralna) i stymulację limfocytów T (cytotoksycznych) (odpowiedź komórkowa).
Szczepionki mRNA przeciw COVID-19 składają się z informacyjnego kwasu rybonukleinowego mRNA kodującej białko S (kolca) wirusa SARS-CoV-2 zamkniętego w kapsułce z nanocząsteczek lipidowych. Kapsułka pełni funkcję ochronną oraz funkcję transportową pomagając przeniknąć do komórki pokonując barierę błony komórkowej. Na podstawie mRNA w komórce gospodarza syntetyzowane jest białko S (kolca) SARS-CoV-2, które będąc silnym antygenem pobudza odpowiedź odpornościową w postaci przeciwciał neutralizujących (odpowiedź humoralna) i stymulację limfocytów T (cytotoksycznych) (odpowiedź komórkowa).
Technologia mRNA została wykorzystana po raz pierwszy w szczepionce firm Pfizer i BioNTech, która została dopuszczona do obrotu w Wielkiej Brytanii, Stanach Zjednoczonych, Kanadzie oraz Szwajcarii i będzie stosowana w masowych szczepieniach przeciw COVID-19.
To prawda, że szczepionki mRNA nigdy wcześniej nie były stosowane u ludzi na szeroką skalę. Jednak platforma mRNA już od wielu lat jest wykorzystywana przy opracowywaniu szczepionek, np. przeciw CMV, Zika, grypie, wściekliźnie, czy malarii. Technologia mRNA jest również z powodzeniem wykorzystywana przy opracowaniu szczepionek nowotworowych i w działaniach terapeutycznych.
mRNA to szczepionka syntetyczna. Jej produkcja nie wymaga pracy z wirusem. Potrzebna jest tylko jego informacja genetyczna. A to właśnie oznacza prawdziwą rewolucję w procesie wytwarzania szczepionki. Omijamy pracę z czynnikiem zakaźnym (wirusem SARS-CoV-2), nie musimy go inaktywować, poddawać atenuacji (osłabiać jego zjadliwości), co ma miejsce przy produkcji klasycznych szczepionek. To znacznie upraszcza cały proces produkcji szczepionki. W szczepionkach klasycznych konieczna była hodowla wirusa w laboratorium, co wymagało czasu oraz specjalistycznych procedur kontroli. Wykorzystanie technologii mRNA eliminuje te wyzwania. Zastosowanie technologii mRNA pozwala również na znaczne skrócenie czasu potrzebnego do wyprodukowania szczepionki, co ma ogromne znaczenie w takiej sytuacji jak pandemia. Przykładowo wyprodukowanie szczepionki przeciw grypie wymaga obecnie około 6 miesięcy, w przypadku szczepionki mRNA jedna seria szczepionki może być wyprodukowana w ciągu zaledwie tygodnia.
Technologia mRNA będzie po raz pierwszy zastosowana w szczepionce podawanej na masową skalę. Technologia ta jest jednak w opracowaniu szczepionek rozwijana od wielu lat, np. w terapii nowotworowej czy opracowaniu różnych szczepionek wirusowych.
Jakie szczepionki przeciw COVID-19 są dopuszczone do obrotu w Unii Europejskiej?
Źródło grafiki: https://www.facebook.com/komisjaeuropejska/

Obecnie w krajach Unii Europejskiej do obrotu dopuszczone są:
- Szczepionka mRNA o nazwie Comirnaty (BNT162b2) firm BioNTech i Pfizer. Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 21.12.2020). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku >6 miesięcy. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz ulotce dla pacjenta dołączonej do opakowania szczepionki.
- Zaktualizowane szczepionki dla wariantu Omikron do podawania jako dawki przypominające: szczepionka Comirnaty Original/Omicron BA.1. (BioNTech i Pfizer) i szczepionka Comirnaty Original/Omicron BA.4-5. (BioNtech i Pfizer).
- Zaktualizowana szczepionka dla podwariantu XBB1.5 do podawania jako dawka przypominająca: szczepionka Comirnaty Original/Omicron XBB1.5 (BioNTech i Pfizer).
- Szczepionka mRNA o nazwie Spikevax (mRNA 1273) firmy Moderna. Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 06.01.2021). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥6 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta.
- Zaktualizowana szczepionka dla wariantu Omikron do podawania jako dawki przypominające: szczepionka Spikevax Bivalent Original/Omicron BA.1. (Moderna) i BA.4-5 (Moderna).
- Zaktualizowana szczepionka dla podwariantu XBB1.5 do podawania jako dawka przypominająca: szczepionka Spikevax XBB1.5 (Moderna).
- Szczepionka wektorowa Vaxzevria (ChAdOx1 nCoV-19) (AstraZeneca). Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 29.01.2021). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat, w postaci dwóch dawek. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta (szczepionka obecnie w Polsce niedostępna).
- Szczepionka wektorowa Jcovden (COVID-19 Vaccine Janssen) (Janssen) (Ad26.COV.2-S). Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja Komisji Europejskiej z 11.03.2021). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta.
- Szczepionka rekombinowana białkowa Nuvaxovid (NVX-CoV2373) (Novavax). Szczepionka została dopuszczona do obrotu w całej Unii Europejskiej w procedurze warunkowego dopuszczenia do obrotu (decyzja wykonawcza Komisji Europejskiej z 20.12.2021 udzielająca na mocy rozporządzenia (WE) nr 726/2004 Parlamentu Europejskiego i Rady pozwolenia na dopuszczenie do obrotu produktu leczniczego stosowanego u ludzi „Nuvaxovid – Szczepionka przeciw COVID-19 (rekombinowana, z adiuwantem). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta.
- Szczepionka rekombinowana białkowa Nuvaxovid zaktualizowana do podwariantu XBB1.5 (Novavax).
- Szczepionka rekombinowana białkowa VidPrevtyn Beta (Sanofi Pasteur). Szczepionka przeciw COVID-19 (z adiuwantem). Szczepionka chroni przed objawami COVID-19 wywołanymi przez koronawirusa SARS-CoV-2. Może być podawana osobom w wieku ≥18 lat. Szczegółowe zalecenia dotyczące stosowania szczepionki przedstawione są w Charakterystyce Produktu Leczniczego oraz Ulotce dla pacjenta (szczepionka w Polsce niedostępna).
Europejska Agencja Leków
- prowadzi procedurę dopuszczenia do obrotu szczepionki przeciw COVID-19:
– szczepionki Skycovion (SK Chemicals GmbH).
- prowadzi procedurę wstępnej etapowej oceny (rolling review) 3 szczepionek przeciw COVID-19:
– szczepionki wektorowej Sputnik V (Gam-COVID-Vac) (Gamaleya Institute),
– szczepionki inaktywowanej (Vero Cell) z adiuwantem Sinovac,
– szczepionki inaktywowanej COVID-19 Vaccine HIPRA (PHH-1V) (HIPRA Human Health S.L.U.).
Jak zbudowana jest szczepionka mRNA przeciw COVID-19 i jak działa?
Szczepionka mRNA przeciw COVID-19 firm Pfizer i BioNTech składa się z mRNA czyli informacyjnego kwasu rybonukleinowego kodującego białko S (kolca) wirusa SARS-CoV-2. Kwas ten zamknięty jest w kapsułce z nanocząsteczek lipidowych. Kapsułka pełni funkcję ochronną zabezpieczając mRNA przed degradacją oraz funkcję transportową pomagając mu dostać się do komórki. Na podstawie mRNA w komórce gospodarza syntetyzowane jest białko S (kolca) SARS-CoV-2, które będąc silnym antygenem pobudza odpowiedź odpornościową w postaci przeciwciał neutralizujących (odpowiedź humoralna) i stymuluje wytwarzanie limfocytów T (odpowiedź komórkowa).
Obecnie na zaawansowanym etapie badań są:
- szczepionka mRNA firm Pfizer/BioNTech (dopuszczona do stosowania w Wielkiej Brytanii, Stanach Zjednoczonych, Kanadzie oraz krajach Unii Europejskiej).
- szczepionka mRNA firmy Moderna,
- szczepionka mRNA firmy Curvac.
Szczepionka mRNA uczy nasz układ immunologiczny jak bezpiecznie rozpoznawać i blokować/neutralizować wirusa SARS-CoV-2.
Jaka jest różnica pomiędzy szczepionką mRNA a dotychczas stosowanymi szczepionkami?
Różnica między szczepionką mRNA a dotychczas stosowanymi szczepionkami dotyczy sposobu i miejsca gdzie produkowane jest białko pełniące role antygenu w szczepionce. W dotychczas stosowanych szczepionkach podawaliśmy gotowe białka (antygeny) lub ich fragmenty, które stymulowały organizm do wytworzenia przeciwciał neutralizujących oraz odpowiedzi na poziomie komórkowym. W przypadku szczepionek mRNA do organizmu podajemy tylko informację genetyczną o tym jak dane białko powinno być wytworzone. Sama produkcja białka zachodzi już w naszych komórkach.
Szczepionka mRNA nie zawiera wirusa ani jego fragmentów. Zawiera tylko informację genetyczną (mRNA), dzięki której białko (antygen) wirusa będzie wytworzone w naszych komórkach po podaniu szczepionki.
Czy przy opracowaniu szczepionek przeciw COVID-19 wykorzystywana jest technologia eksperymentalna?
Opinia, że szczepionki przeciw COVID-19 wykorzystują technologię eksperymentalną, nie jest poparte danymi naukowymi ani toczącym się procesem opracowywania i oceny szczepionek w procesie dopuszczenia ich do obrotu przez urzędy rejestrujące (np. Europejską Agencję Leków). Naukowcy na całym świecie stosowali różne podejścia, aby zmaksymalizować szanse na szybkie opracowanie bezpiecznej i skutecznej szczepionki przeciw COVID-19. Niektóre z tych podejść są dobrze ugruntowane, jak klasyczne szczepionki, które wykorzystują białka do wywołania odpowiedzi immunologicznej (szczepionki podjednostkowe), podczas gdy inne są bardziej nowatorskie, jak szczepionki mRNA lub szczepionki wektorowe.
W szczepionkach mRNA lub wektorowych nie podajemy gotowego antygenu, a dokładny przepis na jego przygotowanie w postaci mRNA kodującego informację o białku S (kolca) SARS-CoV-2 lub innego wirusa (wektora), do którego wbudowany jest gen kodujący syntezę białka S wirusa SARS-CoV-2, pełniącego rolę antygenu.
Technologia mRNA wykorzystana w opracowaniu szczepionek opiera się na zasadach naukowych. mRNA odkryto w 1961 roku. 30 lat później ropoczeto pierwsze badania dotyczące wykorzystania tej technologii w terapii oraz profilaktyce chorób zakaźnych. Platforma mRNA wcześniej była wykorzystywana przy opracowywaniu szczepionek przeciw CMV, wirusowi Zika, grypie czy wściekliźnie, dla których znamy wyniki badań nieklinicznych na modelach zwierzęcych oraz wyniki pierwszej fazy badań klinicznych na ludziach. Technologia mRNA jest również z powodzeniem wykorzystywana przy opracowaniu szczepionek nowotworowych i działaniach terapeutycznych.
Szczepionki wektorowe są stosunkowo nowym podejściem, ale były szeroko badane w badaniach nad HIV oraz innymi chorobami. W 2020 roku w EMA dopuszczono do obrotu szczepionkę przeciw gorączce Ebola, która wykorzystuje wektor zastosowany w szczepionce przeciw COVID-19. Wektor stosowany w szczepionce jest bezpieczny, nie integruje się z DNA człowieka.
Przyspieszony harmonogram opracowywania szczepionek przeciw COVID-19 został narzucony przez wyzwania związane z walką z pandemią SARS-CoV-2. Tak szczepionki mRNA jak i szczepionki wektorowe przeszły wszystkie wymagane etapy badań nieklinicznych i klinicznych, żaden z wymaganych etapów badań nieklinicznych na zwierzętach, ani trzech etapów badań klinicznych na ludziach nie został ominięty. Różnica dotyczy jedynie tego, że poszczególne etapy badań mogą być prowadzone równolegle. Najważniejszy etap badań klinicznych 3 fazy oceniających bezpieczeństwo i skuteczność szczepionki prowadzony jest z udziałem licznych grup od 30 000 do 60 000 uczestników.
W ciągu ostatnich 30 lat stworzono dobrze działający system restrykcyjnych wymagań w procesie dopuszczenia szczepionek do obrotu, do których firma opracowująca szczepionkę musi się dostosować. Wymogi bezpieczeństwa dotyczące opracowywanych szczepionek przeciw COVID-19 są tak samo rygorystyczne, jak w przypadku pozostałych szczepionek dostępnych w UE i pandemia tego nie zmienia.
Przy opracowaniu szczepionek mRNA przeciw COVID-19 bazowano na wcześniej zdobytej wiedzy na temat szczepionek przeciw CMV, Zika, gorączce Ebola, grypie i wściekliźnie.
- Le T.T. i wsp. The COVID-19 vaccine development landscape. Nature reviews. 09 April 2020.
- Folegatti PM i wsp. Safety and immunogenicity of the ChAd0x1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single blind, randomised controlled trial. The Lancet, July 20, 2020.
- Jackso LA i wsp. An mRNA Vaccine against SARS-CoV-2 — Preliminary Report. New England Journal of Medicine, July 14, 2020.
- Coronavirus Vaccine Tracker.
Przeczytaj również


Refundacja szczepionki przeciw ludzkiemu wirusowi brodawczaka (HPV)
CZYTAJ WIĘCEJ

Szczepienia przeciw krztuścowi kobiet w ciąży dołączają do szczepień zalecanych dostępnych bezpłatnie
CZYTAJ WIĘCEJ

Jaką szczepionkę przeciw krztuścowi można podać osobie dorosłej i w jakim schemacie?
CZYTAJ WIĘCEJ


