
Na czym polega proces rejestracji szczepionki?
Szczepionki są rejestrowane w procesie postępowania o wydanie pozwolenia na dopuszczenie do obrotu. Proces ten prowadzi Europejska Agencja Leków (European Medicines Agency, EMA), a w Polsce Urząd Rejestracji Produktów Leczniczych Wyrobów Medycznych i Produktów Biobójczych. Wytwórcy przedstawiają dokumentację z wynikami badań zebranymi w czasie prac rozwojowych szczepionki, wyniki badań klinicznych dotyczące bezpieczeństwa i skuteczności oraz szczegółowy opis procesu wytwarzania i badań jakościowych szczepionki. Eksperci zrzeszeni w stałych komitetach naukowych i grupach roboczych EMA dokładnie sprawdzają zgodność przedstawionej dokumentacji z restrykcyjnymi wytycznymi Farmakopei Europejskiej, EMA oraz WHO pod kątem jakości, bezpieczeństwa ludzi i środowiska i skuteczności, uwzględniającymi najnowszą wiedzę. Wymagania dotyczące szczepionek w monografiach Farmakopei Europejskiej/Farmakopei Polskiej określają proces wytwarzania szczepionki, etapy jego kontroli, zakres kontroli i metody badań. Farmakopea przedstawia rygorystyczne limity dla odczynników, które mogą być stosowane w procesie wytwarzania szczepionki oraz antygenów i substancji pomocniczych, które wchodzą w jej skład. Oceniana w procesie rejestracji dokumentacja obejmuje również wyniki badań stabilności szczepionki przez cały czas kiedy będzie dostępna na rynku, gdzie sprawdza się trwałość odpowiedzi immunologicznej oraz bezpieczeństwo produktu. Na podstawie danych dotyczących profilu bezpieczeństwa danej szczepionki oceniany jest stosunek korzyści i ryzyka.
Rejestracja szczepionki to proces rygorystyczny i czasochłonny. Ocena przez ekspertów EMA trwa 210 dni. Jednak w międzyczasie wytwórca jest zobligowany do wyjaśniania wielu kwestii i przedstawienia dodatkowych informacji, dlatego w praktyce proces rejestracji prowadzony w EMA może trwać nawet 1-1,5 roku.
Szczepionki podobnie jak inne produkty lecznicze mogą być dopuszczone do obrotu:
- Na terenie całej Unii Europejskiej w procedurze centralnej, wtedy proces ten prowadzi Europejska Agencja Leków. Końcowa decyzja o dopuszczeniu preparatu do obrotu ma formę pozwolenia Komisji Europejskiej (EPAR- European Public Assessment Report). Decyzja o dopuszczeniu do obrotu w procedurze centralnej jest ważna we wszystkich krajach Unii Europejskiej.
- W Polsce w trzech procedurach krajowych: narodowej, wzajemnego uznania i zdecentralizowanej, wtedy organem wydającym pozwolenie jest Prezes Urzędu Rejestracji Produktów Leczniczych i Wyrobów Medycznych.
- W Stanach Zjednoczonych odpowiednikiem takich instytucji jest Food and Drug Administration (FDA).
Lista instytucji w Unii Europejskiej, które razem z EMA są odpowiedzialne za rejestrację szczepionek.
- Wymagania według których prowadzona jest rejestracja szczepionek są wyjątkowo restrykcyjne.
- Końcowa pozytywna decyzja o rejestracji szczepionki jest gwarancją jej jakości bezpieczeństwa i skuteczności.
- Większość nowych szczepionek jest rejestrowana na poziomie europejskim.
Rejestracja szczepionek podobnie jak wszystkich produktów leczniczych to obszar uregulowany prawem. Przebiega zgodnie z art. 10 ustawy z dnia 6 września 2001 roku Prawo farmaceutyczne (Dz.U. z 2017 r. poz. 2211 ze zm.) oraz Dyrektywą 2001/83/WE Parlamentu Europejskiego i Rady z dnia 6 listopada 2001 w sprawie wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi.
Powiązane artykuły:
Przeczytaj również
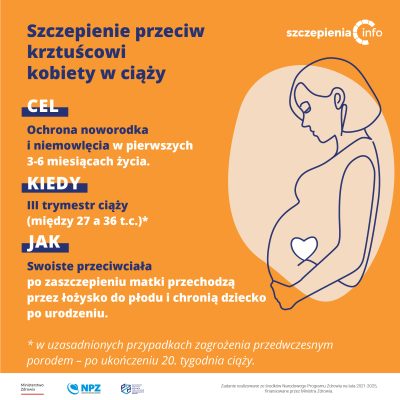
Dlaczego kobiecie w ciąży zaleca się szczepienie przeciw krztuścowi?
CZYTAJ WIĘCEJ
Jak prowadzone są szczepienia przeciw grypie w sezonie 2025/2026?
CZYTAJ WIĘCEJ
Listę zgłoszonych niepożądanych odczynów poszczepiennych należy czytać ze zrozumieniem
CZYTAJ WIĘCEJ

