Gdzie prowadzone są w Polsce badania kontroli jakości szczepionek?
Szczepionki będąc produktami leczniczymi immunologicznymi podlegają przed wprowadzeniem na rynek procesowi kontroli seryjnej wstępnej (KSW) który polega na badaniach jakościowych każdej serii szczepionki oraz ocenie dokumentacji procesu wytwarzania danej serii szczepionki przez niezależne od producenta laboratoria kontroli jakości. Kontrola obejmuje laboratoryjne badania jakościowe danej serii szczepionki zgodnie z zatwierdzonymi w procesie rejestracji wymaganiami. Wykonywane są badania oceny wyglądu szczepionki, jej właściwości fizyko-chemicznych, zawartości środków konserwujących, adiuwantów, substancji stosowanych do inaktywacji oraz innych substancji pomocniczych, identyfikowane są antygeny wirusowe lub bakteryjne, sprawdzana jest aktywność szczepionki, badane jest bezpieczeństwo laboratoryjne.
Podobnie jak w każdym innym kraju członkowskim Unii Europejskiej, w Polsce jest niezależne (akredytowane przez polski i europejski system jakości PCA i EDQM) laboratorium Kontroli jakości szczepionek, tzw. laboratorium OMCL (Official Medicines Control Laboratories). W Polsce to laboratorium mieści się w Narodowym Instytucie Zdrowia Publicznego – Państwowym Zakładzie Higieny, Zakładzie Badania Surowic i Szczepionek i tam prowadzone są badania kontroli jakości każdej serii szczepionki. Laboratorium jako jedyne w Polsce posiada uprawnienia do prowadzenia kontroli jakości szczepionek.
Badania kontroli seryjnej wstępnej prowadzone są zgodnie z:
- wymaganiami art. 114 Dyrektywy 2001/83/WE Parlamentu Europejskiego i Rady, zmienionej przez Dyrektywę 2004/27/WE w ramach tzw. Europejskiej Administracyjnej Procedury Zwalniania Serii (EU Administrative Procedure for Official Control Authority Batch Release)
- ustawodawstwem krajowym (Rozporządzenie Ministra Zdrowia z dnia 10 kwietnia 2013 r. w sprawie kontroli seryjnej wstępnej produktów leczniczych oraz surowców wykorzystywanych do sporządzania leków recepturowych lub aptecznych (Dz.U. 2013 poz. 491).
Badania KSW prowadzone są w Europie przez niezależne od wytwórcy instytuty badawcze oraz laboratoria kontroli jakości leków. Proces ten kończy się wydaniem odpowiedniego orzeczenia dotyczącego badań jakościowych próbki danej serii produktu leczniczego, które jest przekazywane podmiotowi odpowiedzialnemu i stanowi podstawę dopuszczenia danej serii szczepionki na rynek.
Laboratorium kontroli jakości szczepionek OMCL w NIZP-PZH współpracuje z Urzędem Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Środków Biobójczych w ramach weryfikacji zgodności szczepionki z dokumentacją rejestracyjną.
Na potrzeby Ministerstwa Zdrowia dokonuje zwolnienia na rynek każdej serii produktów immunologicznych (szczepionek) i krwiopochodnych.
Realizuje również zadania na zlecenie Głównego Inspektoratu Farmaceutycznego w ramach kontroli produktów leczniczych, w tym szczepionek, z rynku podejrzanych o sfałszowanie lub o nie spełniane wymagań jakościowych.
- Konferencja „Szczepienia to nasze zdrowie i bezpieczeństwo. Bezpieczeństwo szczepionek – badania, kontrola i nadzór”.
- Zasada A. Kontrola jakości szczepionek- krajowe i europejskie standardy .
- Wymagania w procesie dopuszczania szczepionek do obrotu są restrykcyjne. URPLWMiPB.
- Pużuk-Zioło K. Kontrola szczepionek – kto za tym stoi i jak to się robi? CrazyNauka.pl 04/05/2018.
- The role of OMCLs. EDQM.
Powiązane artykuły:
Przeczytaj również
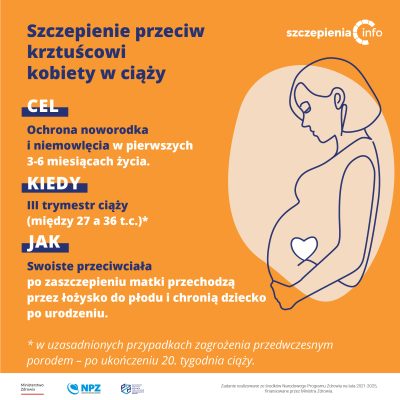
Dlaczego kobiecie w ciąży zaleca się szczepienie przeciw krztuścowi?
CZYTAJ WIĘCEJ
Jak szczepionka przeciw odrze była stosowana w przeszłości?
CZYTAJ WIĘCEJ
Jakie są korzyści ze szczepienia dzieci przeciw ospie wietrznej?
CZYTAJ WIĘCEJ