
Nowa szczepionka w profilaktyce inwazyjnej choroby pneumokokowej i zapalenia płuc u dorosłych
15 lutego 2022 roku Komisja Europejska dopuściła do obrotu po naukowej ocenie Europejskiej Agencji Leków (EMA) nową skoniugowaną szczepionkę przeciw pneumokokom Apexxnar. Nowy produkt jest 20-walentną skoniugowaną szczepionką przeciw pneumokokom (PCV20) do czynnego uodparniania osób w wieku 18 lat i starszych w celu zapobiegania chorobie inwazyjnej i zapaleniu płuc wywoływanym przez bakterie Streptococcus pneumoniae.
Szczepionka zawiera podobny nośnik (białko CRM) i adiuwant (fosforan glinu) jak w szczepionce Prevenar 13. Szczepionka zapobiega poważnym chorobom układu oddechowego, inwazyjnej chorobie pneumokokowej i zapaleniu płuc.
W badaniach klinicznych 3 fazy brało udział ponad 6 000 dorosłych uczestników, w tym osoby w wieku ≥65 lat. Badane populacje obejmowały osoby dorosłe z chorobami przewlekłymi, osoby dorosłe, wcześniej nieszczepione przeciw pneumokokom oraz osoby dorosłe szczepione w przeszłości przeciw pneumokokom.
Szczepionka Apexxnar jest kolejną generacją szczepionek skoniugowanych przeciw pneumokokom firmy Pfizer. W jej składzie są wszystkie serotypy pneumokoka obecne w dostępnej szczepionce 13-walentnej Prevenar (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F i 23F) oraz siedem dodatkowych serotypów (8, 10A, 11A, 12F, 15B, 22F i 33F), które najczęściej wywołują inwazyjną chorobę pneumokokową, zgony i dotyczą szczepów antybiotykoopornych pneumokoka.
Wcześniej szczepionka została zarejestrowana przez amerykańską Agencję Żywności i Leków (FDA, U.S. Food and Drug Administration).
W pierwszej kolejności szczepionka będzie stosowana u dorosłych. Kluczowe wyniki badania klinicznego tej szczepionki u niemowląt są oczekiwane w drugiej połowie 2022 roku. Jeżeli będą pozytywne planowane jest rozpoczęcie procedury oceny w FDA i EMA.
Przeczytaj również

Szczepienia przeciw COVID-19, komu i jak?
CZYTAJ WIĘCEJ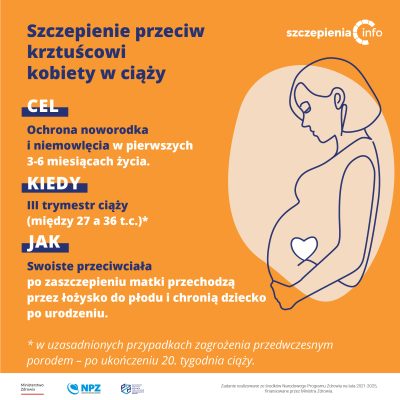
Dlaczego kobiecie w ciąży zaleca się szczepienie przeciw krztuścowi?
CZYTAJ WIĘCEJ
Jakie są zasady szczepień w przypadku alergii na białko jaja kurzego?
CZYTAJ WIĘCEJ

