
Co wiemy na temat bezpieczeństwa szczepionki Nuvaxovid uaktualnionej do podwariantu XBB.1.5?
Dane dotyczące bezpieczeństwa szczepionki Nuvaxovid XBB.1.5 ekstrapolowano z wyników badań bezpieczeństwa szczepionki zawierającej wariant oryginalny oraz na podstawie wykazania podobnego profilu bezpieczeństwa podania dawki przypominającej mRNA o oryginalnym składzie i szczepionką monowalentną uaktualnioną dla podwariantu BA.5 u dorosłych, którzy otrzymali wcześniej ≥3 dawki szczepionki mRNA.
Dane dotyczące bezpieczeństwa szczepionki Nuvaxovid XBB.1.5 ekstrapolowano z wyników:
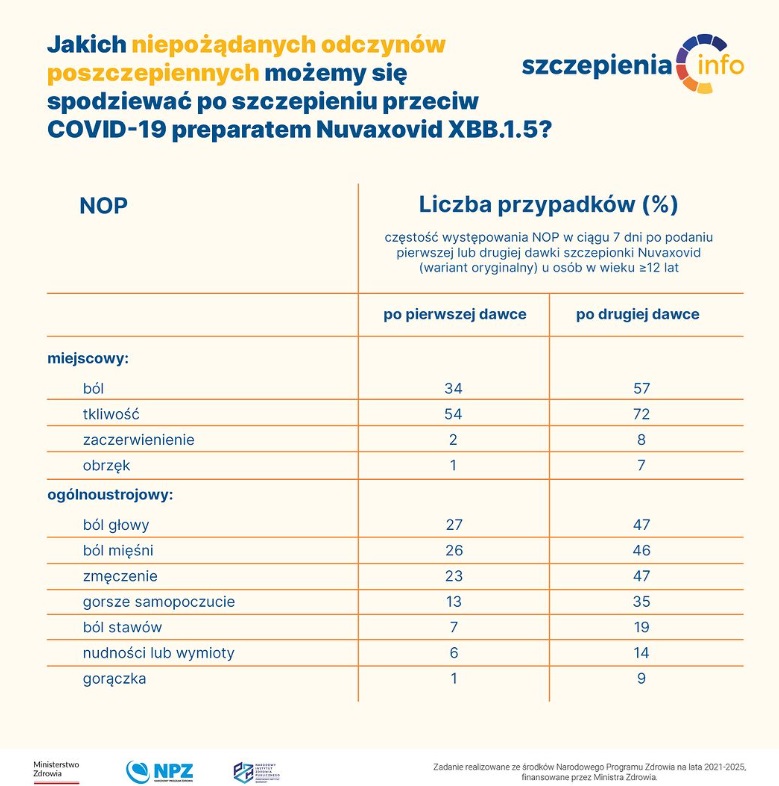
- badań klinicznych, na podstawie których oryginalna szczepionka Nuvaxovid została dopuszczona do obrotu. Znamy wyniki 2 badań z randomizacją prowadzonych w Stanach Zjednoczonych i Meksyku, w których uczestniczyło 29 949 uczestników w wieku ≥18 lat i 1799 uczestników w wieku 12–17 lat oraz wyniki badań prowadzonych w Wielkiej Brytanii w których uczestniczyło 15 187 uczestników w wieku w wieku ≥18 lat. Odnotowano typowe miejscowe i ogólnoustrojowe niepożądane odczyny poszczepienne (NOP), które występowały nieco częściej po drugiej dawce szczepionki niż po pierwszej oraz częściej w młodszych grupach wiekowych niż u starszych dorosłych. Większość NOP miała łagodne lub umiarkowane nasilenie, ustępowała w ciągu maksymalnie 2 dni. Miejscowe lub ogólnoustrojowe NOP o większym nasileniu utrudniającym codzienną aktywność lub wymagające podania leków (np. przeciwbólowych) zgłaszano rzadko, częściej po podaniu drugiej dawki niż pierwszej. Nie odnotowano niepokojących sygnałów dotyczących bezpieczeństwa szczepionki Nuvaxovid – w okresie do 7,5 miesiąca obserwacji.
- badań populacyjnych w ramach nadzoru nad bezpieczeństwem szczepionki preparatu Nuvaxovid (wariant oryginalny). Analiza na podstawie 70 tys. podanych dawek w ramach amerykańskiego systemu VAERS nie ujawniła niepokojących sygnałów dotyczących bezpieczeństwa szczepionki. Na podstawie analizy 210 000 dawek szczepionki Nuvaxovid w krajach UE zgłoszono pojedyncze przypadki zapalenia mięśnia sercowego lub osierdzia. Z analizy danych zebranych w 2022 r. wynika, że po podaniu 1 569 856 dawek szczepionki Nuvaxovid zgłoszono 8 potwierdzonych przypadków zapalenia mięśnia sercowego lub osierdzia w okresie do 28 dni po szczepieniu, a ryzyko oszacowano na 5 przypadków/1 milion podanych dawek. Zachorowania występowały u obu płci i we wszystkich grupach wiekowych. Wskaźnik zgłaszalności przypadków zapalenia mięśnia sercowego lub osierdzia związanych ze szczepieniem Nuvaxovid jest podobny do wskaźnika związanego ze szczepieniem preparatami mRNA Comirnaty lub Spikevax.
- badań klinicznych, gdzie podawano dawkę przypominającą szczepionki Nuvaxovid tak dla schematu szczepienia, gdzie wcześniej podawano szczepionkę Nuvaxovid jak i dla schematu, gdzie wcześniej podawano szczepionkę mRNA lub wektorową. Najczęściej występującym działaniem niepożądanymi był ból w miejscu wstrzyknięcia i zmęczenie.
- badań klinicznych, gdzie oceniano podanie dawki przypominającej mRNA o oryginalnym składzie i szczepionką monowalentną uaktualnioną dla podwariantu BA.5 u dorosłych, którzy otrzymali wcześniej ≥3 dawki szczepionki mRNA. Odnotowano typowe miejscowe i ogólnoustrojowe NOP, tj. tkliwość, ból w miejscu wstrzyknięcia, zmęczenie ból głowy, ból mięśni. Większość z nich miała łagodne lub umiarkowane nasilenie (nie utrudniała zwykłej, codziennej aktywności).
Aktualnie nie ma danych dotyczących ryzyka zapalenia mięśnia sercowego lub osierdzia po podaniu szczepionki Nuvaxovid jako pierwszej lub kolejnej dawki przypominającej lub w ramach schematu mieszanego, gdzie wcześniej pacjentom podawano szczepionkę mRNA lub wektorową.
- Ánez G., Dunkle L.M., Gay C.L. i wsp.: Safety, immunogenicity, and efficacy of the NVX-CoV2373 COVID-19 vaccine in adolescents: a randomized clinical trial. JAMA Netw. Open, 2023; 6 (4): e239135.
- Dunkle L. M. i wsp. Efficacy and safety of NVX CoV2373 in adults in the United States and Mexico. The New England Journal of Medicine, 2021.
- Heath P.T. i wsp. Safety and efficacy of NVX CoV2373 COVID 19 vaccine. The New England Journal of Medicine, 2021; 385: 1172–1183.
- Heath P.T., Galiza E..P, Baxter D.N. i wsp.: Safety and efficacy of the NVX-CoV2373 coronavirus disease 2019 vaccine at completion of the placebo-controlled phase of a randomized controlled trial. Clin. Infect. 2023; 76 (3): 398–407.
- Ściubisz M. Co aktualnie wiadomo o tolerancji i bezpieczeństwie szczepionki Nuvaxovid przeciwko COVID-19? Medycyna praktyczna /Szczepienia.






