
Europejska Agencja Leków wyjaśnia jak wygląda proces opracowania, oceny, dopuszczenia do obrotu i monitorowania bezpieczeństwa szczepionek przeciw COVID-19
Opublikowano w dniu: 12 grudnia 2020
11 grudnia 2020 roku Europejska Agencja Leków zorganizowała webinar dotyczący opracowania i oceny szczepionek przeciw COVID-19. Celem spotkania było wyjaśnienie wszystkim zainteresowanym stronom jak wygląda proces opracowania, oceny, dopuszczenia do obrotu i monitorowania bezpieczeństwa szczepionek przeciw COVID-19, w tym również na czym polega specyficzna rola EMA.
EMA wyjaśniła, że w czasie spotkania nie podejmowano tematów dotyczących dostępu pacjentów do szczepień przeciw COVID-19 oraz krajowych kampanii szczepień, ponieważ nie dotyczą kompetencji agencji rejestrującej.
Przedstawione w czasie spotkania potrzeby, oczekiwania i wszelkie obawy ze strony opinii publicznej oraz grup interesariuszy, zostaną uwzględnione przez EMA oraz europejską sieć regulacyjną produktów leczniczych w procesie decyzyjnym.
Przedstawione w czasie spotkania potrzeby, oczekiwania i wszelkie obawy ze strony opinii publicznej oraz grup interesariuszy, zostaną uwzględnione przez EMA oraz europejską sieć regulacyjną produktów leczniczych w procesie decyzyjnym.
Na stronie EMA dostępne jest nagranie ze spotkania oraz prezentacje:
Agenda- EMA public stakeholder meeting on COVID-19.
How are COVID-19 vaccines developed?
EU’s regulatory process for evaluation and approval of vaccines (Fergus Sweeney)
Safety monitoring of COVID-19 vaccines (Peter Arlett)
Transparency, engagement and communication (Melanie Carr)
Agenda- EMA public stakeholder meeting on COVID-19.
How are COVID-19 vaccines developed?
EU’s regulatory process for evaluation and approval of vaccines (Fergus Sweeney)
Safety monitoring of COVID-19 vaccines (Peter Arlett)
Transparency, engagement and communication (Melanie Carr)
Obecnie EMA prowadzi ocenę:
w procedurze warunkowego dopuszczenia do obrotu (conditional marketing authorisation):
• Szczepionka mRNA BNT162b2 firm BioNTech we współpracy z Pfizer (procedura warunkowego dopuszczenia do obrotu rozpoczęła się 01/12/2020; procedura etapowej oceny (rolling review) rozpoczęła się 06/10/2020).
• Szczepionka mRNA-1273 firmy Moderna (procedura warunkowego dopuszczenia do obrotu rozpoczęła się 01/12/2020; procedura etapowej oceny (rolling review) rozpoczęła się 16/11/2020).
w procedurze warunkowego dopuszczenia do obrotu (conditional marketing authorisation):
• Szczepionka mRNA BNT162b2 firm BioNTech we współpracy z Pfizer (procedura warunkowego dopuszczenia do obrotu rozpoczęła się 01/12/2020; procedura etapowej oceny (rolling review) rozpoczęła się 06/10/2020).
• Szczepionka mRNA-1273 firmy Moderna (procedura warunkowego dopuszczenia do obrotu rozpoczęła się 01/12/2020; procedura etapowej oceny (rolling review) rozpoczęła się 16/11/2020).
w procedurze etapowej oceny (rolling review):
• Szczepionka wektorowa ChAdOx1-SARS-CoV-2 firm AstraZeneca we współpracy z University of Oxford (procedura rozpoczęła się 01/10/2020).
• Szczepionka wektorowa Ad26.COV2.S firmy Janssen- Cilag International (procedura rozpoczęła się 01/12/2020).
• Szczepionka wektorowa ChAdOx1-SARS-CoV-2 firm AstraZeneca we współpracy z University of Oxford (procedura rozpoczęła się 01/10/2020).
• Szczepionka wektorowa Ad26.COV2.S firmy Janssen- Cilag International (procedura rozpoczęła się 01/12/2020).
Więcej informacji na stronie EMA:
• Treatments and vaccines for COVID-19
• COVID-19 vaccines: key facts
• COVID-19 vaccines: development, evaluation, approval and monitoring
• Treatments and vaccines for COVID-19
• COVID-19 vaccines: key facts
• COVID-19 vaccines: development, evaluation, approval and monitoring
Przeczytaj również

Szczepienia przeciw COVID-19, komu i jak?
CZYTAJ WIĘCEJ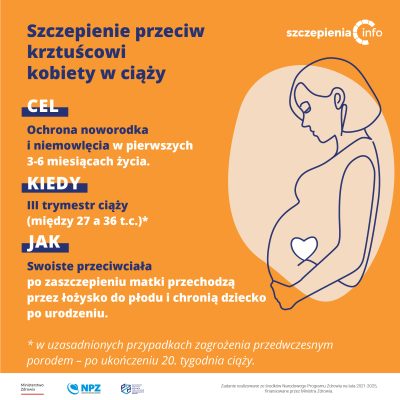
Jaki jest stan zaszczepienia przeciw odrze w Polsce?
CZYTAJ WIĘCEJ
Gdzie można znaleźć informacje na temat stanu zaszczepienia przeciw HPV w Polsce?
CZYTAJ WIĘCEJ

